Tetrandrine enhances the radiosensitivity of p53-deficient non-small cell lung cancer by promoting HIF-1α degradation
-
摘要:目的 探讨汉防己甲素(tetrandrine,TET)增强非小细胞肺癌(non-small cell lung cancer,NSCLC)放疗敏感性的作用机制。方法 通过CCK-8法检测H1299和Calu-1细胞活力,并结合克隆形成实验检测在常规或缺氧条件下,TET对NSCLC放疗敏感性的影响。研究TET对NSCLC中由辐射和缺氧诱导的缺氧诱导因子-1α(hypoxia inducible factor-1,HIF-1α)及血管内皮生长因子(vascular endothelial growth factor,VEGF)表达的影响,并敲低HIF-1α基因进一步验证。通过逆转录聚合酶链反应(reverse tran-scription-polymerase chain reaction,RT-PCR)、环己酰亚胺(cycloheximide,CHX)追踪及免疫沉淀法检测TET对HIF-1α降解的影响,并探讨p53在TET放疗增敏中的作用。结果 TET可显著增强p53缺陷型NSCLC细胞的放疗敏感性,而对p53野生型的细胞作用不明显。辐射和缺氧暴露后,TET明显抑制HIF-1α及VEGF的表达。TET可通过蛋白泛素化降解系统加速HIF-1α的降解。野生型p53基因转染到H1299细胞中可减弱TET抑制HIF-1α表达的作用。结论 TET通过促进HIF-1α降解抑制HIF-1α通路,使p53缺陷型NSCLC细胞对辐射敏感,而p53在TET诱导的HIF-1α降解中发挥抑制作用。Abstract:Objective To explore the specific mechanisms by which tetrandrine (TET) enhances the radiosensitivity of non-small cell lung cancer (NSCLC).Methods Cell viability was assessed via CCK-assay, combined with the colony formation experiment to detect the effect of TET on the radiosensitivity of NSCLC under conventional or hypoxic conditions. The effect of TET on hypoxia inducible factor-1 (HIF-1α) and vascular endothelial growth factor (VEGF) in NSCLC induced by ionising radiation (IR) and hypoxia was investigated. To investigate the impact of decreased HIF-1α expression on radiosensitivity, HIF-1α was knocked down. The effect of TET on HIF-1α degradation was investigated via reverse transcription-polymerase chain reaction (RT-PCR), cycloheximide (CHX) tracking, and immunoprecipitation. The role of p53 in TET-induced radiosensitization was also explored.Results While TET significantly enhances the radiosensitivity of p53-deficient NSCLC cells, it has no significant impact on the radiosensitivity of cells expressing normal level of p53. Exposure to TET after IR and hypoxia significantly inhibits HIF-1α and VEGF expression. This effect is attributable to TET-induced HIF-1α ubiquitination, which accelerates HIF-1α degradation via the ubiquitin proteasomal system. Transfection of wild-type p53 into H1299 cells attenuates the impact of TET on HIF-1α expression.Conclusions Inhibition of the HIF-1α pathway by TET is achieved via promoting HIF-1α degradation, which sensitizes p53-deficient NSCLC cells to IR. The presence of p53 inhibits TET-induced HIF-1α degradation.
-
肺癌是全球发病率和死亡率最高的恶性肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)是最常见的肺癌组织学亚型[1-2]。放疗由于其对NSCLC显著疗效而被广泛使用,尤其是在肿瘤多发而无法切除的患者中[3-4]。但放疗抵抗是限制放疗的主要因素。已有多项研究报道放疗抵抗潜在的发生发展机制,据报道缺氧与放疗抵抗有关,而缺氧诱导因子-1 (hypoxia inducible factor-1,HIF-1)在与缺氧有关的放疗抵抗中发挥主要作用[5-6]。汉防己甲素(tetran- drine,TET)是从防己科植物粉防己(stephamiatetran-dra S.Moore)块根中提取的一种双苄基异喹啉类生物碱,具有消炎、抗自由基损伤、抗肝纤维化和抗肿瘤等多种药理作用,临床用于早期轻度高血压、风湿痛、肝癌、晚期肺癌、膀胱癌以及白血病的治疗[7]。近年来,研究发现TET对NSCLC具有放疗增敏作用[8],然而具体机制尚不清晰。
1. 材料与方法
1.1 细胞培养和试剂
人NSCLC细胞系H1299(p53- null),Calu- 1 (p53-null)和H460(wild-type p53)购自中国科学院细胞库。H1299和Calu-1细胞系在RPMI 1640培养基(美国HyClone)中培养,H460在DMEM培养基(美国HyClone)中培养,均添加10%胎牛血清(FBS,美国HyClone)和100 g/mL链霉素和100 U/mL青霉素(美国Gibco)。对于常氧培养,细胞培养于5%CO2,37℃的培养箱中。对于缺氧培养,细胞培养于1%O2,94% N2和5%CO2的37℃培养箱中。所有细胞系均不含支原体。TET(中国阿拉丁生化科技有限公司),蛋白质合成抑制剂环己酰亚胺(cycloheximide,CHX,美国Sigma)和蛋白酶体抑制剂MG132(美国Sigma)溶解在DMSO中。
抗体:anti-HIF-1α(1:1 000,Protein Tech Group,中国),anti-ubiquitin(1: 1 000,Cell Signaling Technology,美国),anti-γ-H2AX(phosphoS139,1:1 000,Abcam,英国),anti-IκBα(1: 1 000,Cell Signaling Technology,美国),anti-phospho-IκBα(Ser32/36,1: 1 000,Cell Sig- naling Technology,美国)及anti-β-actin(1:1 000,Protein Tech Group,中国)。
1.2 方法
1.2.1 放疗
用X射线辐射器(SHINVA,中国)对细胞进行不同剂量(0~8 Gy)的辐射,剂量率为0.189 Gy/min。
1.2.2 细胞活力测定
TET(0~60 μM)预处理细胞(6 h)。对于缺氧暴露,在TET给药后4 h,将细胞移入缺氧状态持续2 h,然后进行辐射。辐射后,将含TET的培养基替换为普通培养基,辐射后72 h通过CCK-8法评估细胞活力。每孔加入200 μL CCK-8溶液,并在37℃下孵育1 h后,使用酶标仪(美国Molecu- larDevice)测定450 nm处的吸光度。使用Graphpad Prism 7.0软件计算IC50。
1.2.3 克隆形成实验
将细胞以200~5 000个细胞/皿的密度接种到35 mm培养皿中,贴壁后将细胞用TET进行预处理(6 h),其后进行辐射。对于缺氧暴露,在TET给药后4 h,将细胞移入缺氧状态持续2 h,然后进行辐射。辐射后,将含TET的培养基替换为普通培养基,并将细胞维持在常氧条件下。8~12天后,洗涤细胞,用1%结晶紫染色,并计数包含50个细胞的细胞群体。接种效率(PE)=平均细胞群体数/接种的细胞数。存活分数(SF)=实验组克隆数(/接种细胞数×PE)。用Origin 8.0软件构建存活曲线。生存曲线参数平均致死剂量(D0)和准阈剂量(Dq)通过将数据与单击多目标模型拟合计算。
1.2.4 Western Blot和免疫沉淀
RIPA裂解液提取细胞蛋白,并用BCA试剂盒测定蛋白浓度。用6%~12%的SDS-PAGE分离蛋白,并转移至PVDF膜上。将膜在5%脱脂奶粉中封闭1 h,一抗孵育过夜(4℃)。用TBST缓冲液充分洗涤后,将其与辐射Dye偶联的二抗(1:10 000,美国Li-COR Biosciences)在室温下孵育1 h后,用Od- yssey CLx红外线捕获免疫反应带的图像。
为了进行免疫沉淀(immunoprecipitation,IP),将anti-HIF-1α(英国Abcam)与4 mg细胞裂解液共同孵育,然后用蛋白A/G琼脂糖捕获。充分洗涤磁珠,然后将其悬浮在SDS上样器中以进行蛋白质印迹分析。
1.2.5 RT-PCR
RT-PCR用One Step SYBRⓇ Prime Script TMRT-PCR试剂盒(中国Takara Bio)在Roche480轻型循环仪(Roche)上进行。用于PCR扩增的引物如下:HIF-1α上游5'-GAACGTC GAAAAGAAAAGTCTCG-3',下游:5'-CCTTATCA AGATGCGAACTCACA-3';VEGF上游:5'-AGGGCAGA ATCATCACGAAGT-3',下游5'-AGGGTCT CGATTGGATGGCA-3';ACTB上游:5'-CTGGGAC GACATGGAGAAAA-3',下游:5'-AAGGAAG GCTGGAAGAGTGC-3'。通过2-∆∆Ct公式计算基因表达相对变化,将ACTB作为内参。
1.2.6 小干扰RNA转染
使用Lipofectamine 2000 Transfection Reagent (美国Invitrogen),根据说明书使用负性RNA序列(siNC)或HIF-1α小干扰RNA(siHIF-1α,中国Gene Pharma)对细胞进行转染。siHIF-1α的靶序列如下:siHIF-1α-1,GGGTAAAGAACAAAACACA;siHIF-1α-2,AACTAACT GGACACAGTGTGT。siNC和siHIF-1α转染48 h后,将细胞用于进一步实验。
1.2.7 逆转录病毒感染
通过将人全长TP53 cDNA (NM_000017.11)亚克隆到pCDH-CMV-MCS-EF1- Puro慢病毒质粒中来构建p53过表达质粒。如前所述,通过将HEK293T细胞与p53过表达的质粒和包装质粒(psPAX2和pMD2.G)共转染制备慢病毒。用慢病毒感染H1299细胞,并且从感染后48 h开始,用嘌呤霉素(2 μg/mL)选择表达p53的稳定细胞系。
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析,所有实验至少进行3次。数据表示为x±s表示,使用t检验对差异进行评估。以P<0.05为差异具有统计学意义。
2. 结果
2.1 TET抑制NSCLC细胞生长
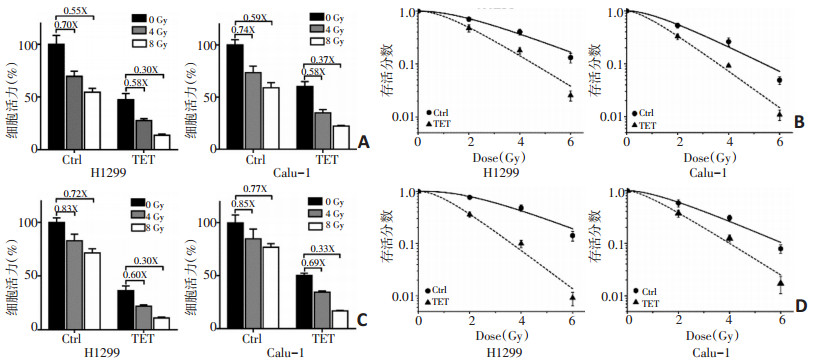
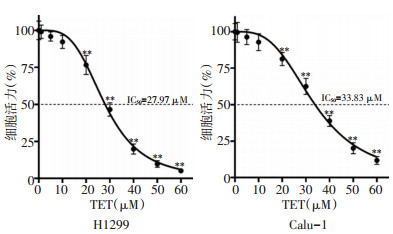
将H1299和Calu-1细胞以不同浓度的TET处理6 h后检测细胞活力,以评估TET对NSCLC的杀伤作用。以5、10 μM TET处理6 h的H1299和Calu-1细胞的细胞活力仍高于90%,提示TET在浓度<20 μM下的细胞毒性较弱。当用较高浓度的TET(≥20 μM)处理细胞后,观察到细胞活力被显著抑制。TET对H1299和Calu-1细胞的IC50分别为27.97 μM和33.83 μM,提示TET以剂量依赖性方式发挥细胞杀伤作用(图 1)。
2.2 在常氧和缺氧条件下,TET均会增加NSCLC的放疗敏感性
在有(无)TET处理的细胞中进行辐射,然后通过CCK-8测定H1299和Calu-1细胞的细胞活力,以确定TET是否可以增加NSCLC的放疗敏感性。H1299细胞的相对细胞活力在20 μM的TET处理下进行4 Gy的辐射后降至27.65%±1.80%,显著低于仅辐射处理(69.80%±4.84%,P=0.003)或仅TET处理(47.32%± 6.01%,P=0.007)。Calu-1细胞的相对细胞活力也显示出相似的趋势。8 Gy的辐射照射后也观察到相似结果(图 2A)。进一步进行克隆形成实验以测试TET在H1299和Calu-1细胞中的放疗增敏效率(图 2B)。暴露于相同的辐射剂量(2~6 Gy)后,TET预处理的H1299和Calu-1细胞的相关细胞活力显著低于各自的对照(未进行TET处理)。TET处理后NSCLC放疗敏感性显著增加(表 1)。
表 1 常氧下MCL预处理辐射后H1299和Calu-1细胞的存活曲线参数
进一步研究缺氧条件下TET是否在NSCLC中发挥放疗增敏作用。在缺氧条件下进行4 Gy辐射后,H1299细胞的相对细胞活力降至83.07%±5.85%,高于常氧条件下的相对细胞活力69.80%±4.84%,Calu-1细胞的相对细胞活力减少至84.86%±9.27%(图 2C),同样高于常氧条件73.56%±6.14%。结果提示TET可增强H1299和Calu-1细胞在缺氧和常氧下的放疗敏感性。克隆形成实验进一步证实缺氧下TET对NSCLC的放疗增敏作用(图 2D)。在缺氧状态下进行TET处理后,增敏比(sensitization enhancement ratio for Dq,SERDq)在H1299中增加至2.59,在Calu-1中增加至1.82(表 2)。
表 2 缺氧下MCL预处理辐射后H1299和Calu-1细胞的存活曲线参数
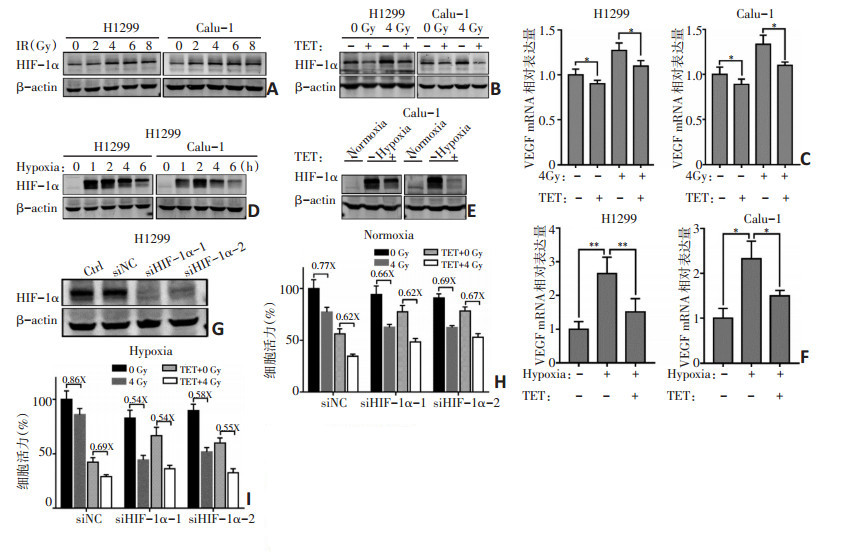
2.3 TET抑制NSCLC中辐射和缺氧诱导的HIF-1α表达
在辐射6 h后,H1299和Calu-1细胞中HIF-1α的表达升高,辐射剂量增加(>4 Gy)并未诱导HIF-1α表达进一步增高(图 3A)。但在H1299和Calu-1细胞中进行TET(20 μM)预处理后再进行4 Gy辐射可有效抑制辐射诱导的HIF-1α表达(图 3B)。此外,RTPCR结果提示,辐射后HIF-1α下游靶标VEGF的水平显著升高,但可被TET预处理抑制(图 3C)。
![]() 图 3 TET抑制辐射和缺氧诱导的HIF-1α表达A:辐射6 h后,H1299和Calu-1细胞中HIF-1α蛋白表达增加;B、C:辐射6 h后,在有无20 μM TET预 处理的情况下,H12-1和Calu-1细胞中HIF-1α蛋白(B)和VEGF mRNA(C)的表达;D:缺氧暴露后不同 时间点 H1299和 Calu-1细胞中 HIF-1α蛋白的表达;E、F:在有无 TET情况下暴露于缺氧后,HIF-1α蛋 白(E)和VEGF mRNA(F)在指定细胞中的表达;G:siHIF-1α转染H1299细胞48 h测定HIF-1α表达;I: 在常氧(H)和缺氧(I)条件下,在有无 TET(20 μM)预处理下,辐射 72 h后评估 siNC和 siHIF-1α H1299 细胞的相对细胞活力;*:P<0.05,**:P<0.01
图 3 TET抑制辐射和缺氧诱导的HIF-1α表达A:辐射6 h后,H1299和Calu-1细胞中HIF-1α蛋白表达增加;B、C:辐射6 h后,在有无20 μM TET预 处理的情况下,H12-1和Calu-1细胞中HIF-1α蛋白(B)和VEGF mRNA(C)的表达;D:缺氧暴露后不同 时间点 H1299和 Calu-1细胞中 HIF-1α蛋白的表达;E、F:在有无 TET情况下暴露于缺氧后,HIF-1α蛋 白(E)和VEGF mRNA(F)在指定细胞中的表达;G:siHIF-1α转染H1299细胞48 h测定HIF-1α表达;I: 在常氧(H)和缺氧(I)条件下,在有无 TET(20 μM)预处理下,辐射 72 h后评估 siNC和 siHIF-1α H1299 细胞的相对细胞活力;*:P<0.05,**:P<0.01缺氧条件下H1299和Calu-1细胞中HIF-1α表达增加,在缺氧2 h左右达到峰值(图 3D)。在缺氧培养前,使用TET预处理H1299和Calu-1细胞4 h,以评估TET对缺氧诱导的细胞中HIF-1α表达的影响。TET预处理可显著抑制缺氧诱导的H1299和Calu-1细胞中HIF-1α表达(图 3E),同时缺氧诱导细胞中的VEGF mRNA表达也显著降低(图 3F)。
通过细胞活性检测评估敲除HIF-1α后TET对H1299的放疗增敏作用,以进一步证实TET通过诱导HIF-1α表达降低发挥放疗增敏作用。HIF-1α siRNA转染细胞后HIF-1α表达显著下调(图 3G)。细胞活力分析表明,TET预处理不会增加敲除HIF-1α的H1299细胞对辐射的敏感性(图 3H~I)。
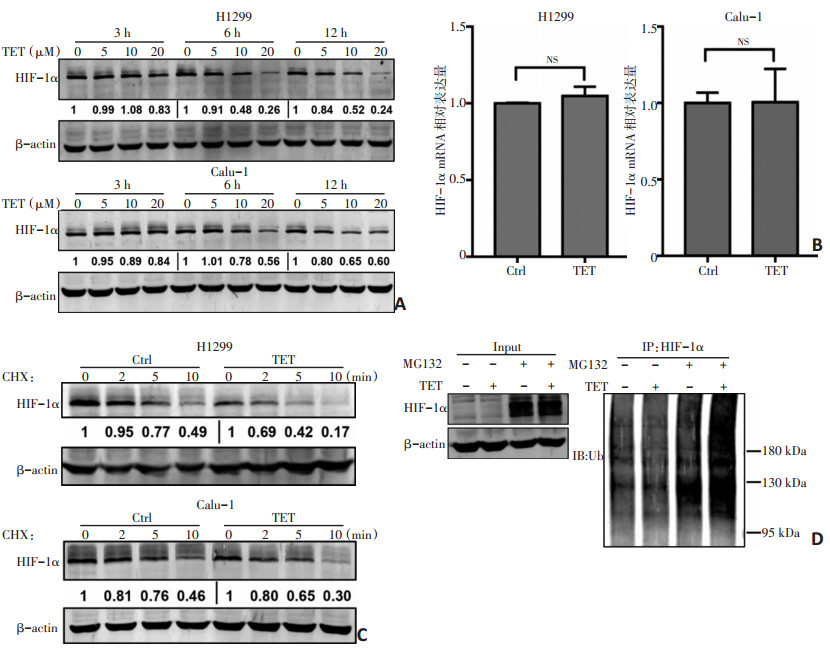
2.4 TET促进HIF-1α降解
TET处理后,H1299和Calu-1细胞中的HIF-1α蛋白水平均呈剂量依赖性降低(图 4A)。TET(20 μM)处理后,通过RT-PCR检测HIF-1α mRNA表达,以验证HIF-1α蛋白表达降低是否是由于HIF-1α基因转录受抑制。然而,在有无TET处理的条件下,H1299和Calu-1细胞中均未发现HIF-1α mRNA表达的变化(图 4B),提示TET导致的HIF-1α蛋白表达降低并不是通过抑制转录实现。考虑到蛋白质降解也可能导致HIF-1α蛋白表达降低,通过检测CHX追踪的HIF-1α蛋白质在有无TET预处理的H1299和Calu-1细胞中的转换率。CHX(100 μg/mL)用于阻断细胞总蛋白合成,并分别于第2、5、10 min进行追踪,发现TET预处理细胞中HIF-1α蛋白含量的下降速度比未进行TET处理的细胞中更快,提示TET加速HIF-1α蛋白的降解(图 4C)。由于HIF-1α蛋白主要通过泛素-蛋白酶体途径降解,因此通过免疫沉淀实验检测蛋白酶体抑制剂(MG132)处理后的H1299和Calu-1细胞中HIF-1α蛋白的水平。MG132(20 μM)对蛋白酶体的抑制导致多泛素化的HIF-1α的形成,与未经TET处理的细胞相比,经TET处理的H1299和Calu-1细胞存在更多的多泛素化HIF-1α(图 4D)。
2.5 p53降低TET的放疗增敏作用
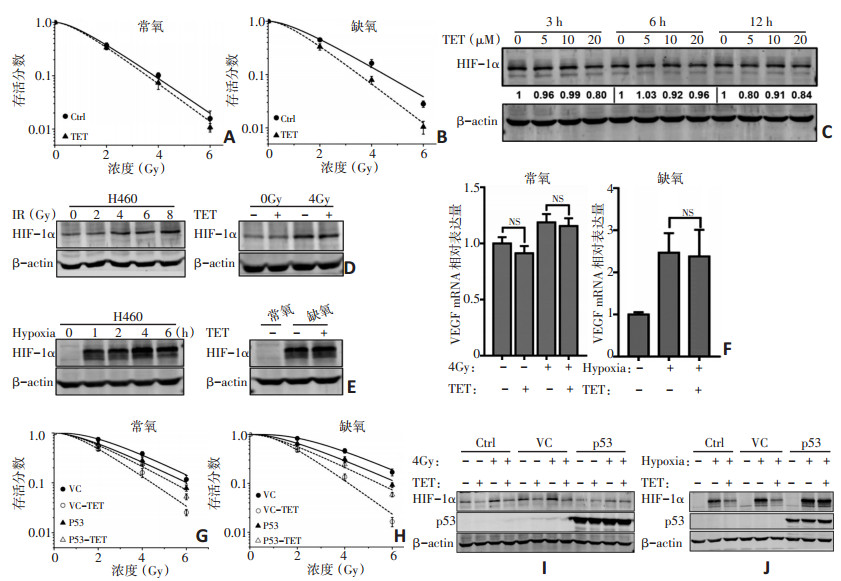
在常氧和缺氧条件下,经TET处理的H460的相对细胞活力在暴露于相同剂量的辐射(2~6 Gy)后略低于对照细胞,SERDq在常氧下增加至1.07,在缺氧下增加至1.21,明显低于p53野生型的H1299和Calu-1细胞(表 3,图 5A,B)。在H460细胞中进行TET处理后,未观察到HIF-1α蛋白水平显著降低(图 5C)。此外,进一步评估TET对H460细胞中辐射或缺氧诱导细胞中的HIF-1α表达的抑制能力。在H460细胞中,辐射仅诱导HIF-1α的轻微表达,并且在辐射后使用TET(20 μM)无法阻断HIF-1α的表达(图 5D)。尽管缺氧可诱导H460细胞中HIF-1α的表达,但TET处理并未影响HIF-1α的表达(图 5E)。此外,在H460细胞中进行辐射或缺氧处理后,TET也不影响VEGF mRNA的表达(图 5F)。
表 3 常氧和缺氧条件下经TET预处理的H460细胞辐射后的存活曲线参数
![]() 图 5 p53通过抑制HIF-1α蛋白降低来减弱TET的放疗增敏作用A、B:在常氧(A)和缺氧(B)条件下,有无TET预处理的辐射后H460细胞的存活曲线;C:不同浓度TET处理后的H460细胞在不同时间点的HIF- 1α蛋白水平;D:在有无TET(20 μM)的情况下,用不同剂量辐射处理的H460细胞中HIF-1α蛋白的表达情况;E:在有无TET(20 μM)的情况下暴露于缺氧条件后,H460细胞中HIF-1α蛋白在不同时间点的表达情况;F:在有无TET(20 μM)处理后,H460细胞辐射后6 h或缺氧2 h时VEGF mRNA的水平;G、H:在常氧(G)和缺氧(H)下,有无TET预处理的辐射后VC和P53 H1299细胞的存活曲线;I:TET预处理对不同细胞系中辐射诱导的HIF-1α表达的影响;J:TET预处理对不同细胞系中缺氧诱导的HIF-1α表达的影响;VC:空白对照组
图 5 p53通过抑制HIF-1α蛋白降低来减弱TET的放疗增敏作用A、B:在常氧(A)和缺氧(B)条件下,有无TET预处理的辐射后H460细胞的存活曲线;C:不同浓度TET处理后的H460细胞在不同时间点的HIF- 1α蛋白水平;D:在有无TET(20 μM)的情况下,用不同剂量辐射处理的H460细胞中HIF-1α蛋白的表达情况;E:在有无TET(20 μM)的情况下暴露于缺氧条件后,H460细胞中HIF-1α蛋白在不同时间点的表达情况;F:在有无TET(20 μM)处理后,H460细胞辐射后6 h或缺氧2 h时VEGF mRNA的水平;G、H:在常氧(G)和缺氧(H)下,有无TET预处理的辐射后VC和P53 H1299细胞的存活曲线;I:TET预处理对不同细胞系中辐射诱导的HIF-1α表达的影响;J:TET预处理对不同细胞系中缺氧诱导的HIF-1α表达的影响;VC:空白对照组设计稳定表达p53(P53)以及对照载体(VC),并转染H1299细胞进行克隆形成实验,以进一步证实p53对TET的放疗增敏作用具有拮抗作用。在常氧和缺氧条件下,与对照组(单独照射)相比,辐射在VC H1299细胞中,辐射显著降低了经TET处理的细胞的相对细胞活力,但在p53 H1299细胞中却没有(图 5G,H)。在常氧和缺氧条件下,TET处理的VC H1299细胞中SERDq分别增至1.89和2.10,而P53 H1299细胞中SERDq分别为1.04和1.30,提示TET的放疗增敏作用被p53显著抑制(表 4)。TET预处理可有效抑制对照和VC H1299细胞中的辐射和缺氧诱导的HIF-1α表达,但p53 H1299细胞中HIF-1α表达不受TET影响(图 5I,J)。
表 4 常氧和缺氧条件下经TET预处理的辐射VC和p53 H1299细胞辐射后的存活曲线参数
3. 讨论
HIF-1α是放疗敏感性的关键因素[9-10]。由于辐射和缺氧诱导HIF-1α活性增加,抑制HIF-1α表达被认为是降低肿瘤放疗抵抗的合理策略[11-13]。本研究中,辐射或缺氧暴露后,H1299和Calu-1细胞中HIF-1α表达均显著升高。在缺氧条件下,H1299和Calu-1细胞中较高的放疗抵抗性证实了HIF-1α在放疗抵抗中的关键作用。同时,本研究结果表明,TET处理可抑制H1299和Calu-1细胞中辐射和缺氧诱导的HIF-1α表达。敲低HIF-1α明显减弱了TET对H1299细胞的放疗增敏作用,证实HIF-1α是TET放疗增敏的关键靶标。此外,TET还抑制了辐射和缺氧诱导的VEGF mRNA表达,提示其对HIF-1α/VEGF途径的抑制。VEGF是HIF-1α的靶基因之一,在暴露于辐射或缺氧后表达增加,抑制VEGF或VEGFR是改善临床肿瘤放疗敏感性的有效策略[14-16]。因此,本研究推测抑制HIF-1α/VEGF途径可能是TET的潜在放疗增敏机制。这一推测也得到了另一项研究的支持,该研究利用NVP- BEZ235或UO126抑制HIF1-/VEGF途径导致子宫内膜癌细胞的放疗增敏[17]。
蛋白表达可在转录和蛋白水平上被调节,本研究发现TET不会影响HIF-1α mRNA的表达,但会降低HIF-1α蛋白表达水平,提示TET在蛋白水平上调节HIF-1α的表达。HIF-1α在蛋白水平上的调节是通过调节蛋白质合成和降解来实现。据报道,磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)或有丝分裂原活化的蛋白激酶(mitogen- activated protein kinase,MAPK)途径的激活参与了HIF-1α的合成[18-19]。HIF-1α的降解主要通过泛素-蛋白酶体系统调控。此外,CHX追踪分析的结果表明,TET通过促进HIF-1α蛋白的降解速率而降低HIF-1α蛋白的稳定性。进一步研究表明,在存在TET的情况下,HIF-1α的泛素化水平比在MG132处理后不存在TET的情况下高。同时,TET诱导的HIF-1α泛素化也提示TET可影响泛素-蛋白酶体途径中HIF-1α的稳定性。最近研究报道表明,HIF-1α的降解被组蛋白脱乙酰基酶(histone deacetylase,HDAC)抑制,尤其是HDAC1和HDAC3,其可与HIF-1α的氧依赖性降解域(oxygen- dependent degradation domain,ODDD)结合。此外,HDAC1调节泛素连接酶(E3)蛋白复合物von Hippel-Lindau蛋白(pVHL)的还原,该复合物介导HIF-1α的降解。因此,TET可能通过下调HDAC1来加速HIF-1α的泛素化和蛋白酶体降解过程。此外,本研究发现在野生型p53细胞中未观察到TET的放疗增敏作用,TET处理未能抑制野生型p53野生型无作用细胞中辐射和缺氧诱导的HIF-1α蛋白和VEGF mRNA的表达。考虑到p53在调节TET放疗敏感性中的重要作用,应在使用TET作为放疗增敏剂之前检测NSCLC患者的p53状况。
综上所述,TET通过抑制HIF-1α表达及其下游靶点VEGF增强p53缺陷型的NSCLC细胞的放疗敏感性。TET可通过促进泛素依赖性HIF-1α蛋白降解来抑制HIF-1α表达。但是,p53的存在可通过拮抗TET介导的HIF-1α降低来减弱TET的放疗增敏作用。
-
图 3 TET抑制辐射和缺氧诱导的HIF-1α表达
A:辐射6 h后,H1299和Calu-1细胞中HIF-1α蛋白表达增加;B、C:辐射6 h后,在有无20 μM TET预 处理的情况下,H12-1和Calu-1细胞中HIF-1α蛋白(B)和VEGF mRNA(C)的表达;D:缺氧暴露后不同 时间点 H1299和 Calu-1细胞中 HIF-1α蛋白的表达;E、F:在有无 TET情况下暴露于缺氧后,HIF-1α蛋 白(E)和VEGF mRNA(F)在指定细胞中的表达;G:siHIF-1α转染H1299细胞48 h测定HIF-1α表达;I: 在常氧(H)和缺氧(I)条件下,在有无 TET(20 μM)预处理下,辐射 72 h后评估 siNC和 siHIF-1α H1299 细胞的相对细胞活力;*:P<0.05,**:P<0.01
图 5 p53通过抑制HIF-1α蛋白降低来减弱TET的放疗增敏作用
A、B:在常氧(A)和缺氧(B)条件下,有无TET预处理的辐射后H460细胞的存活曲线;C:不同浓度TET处理后的H460细胞在不同时间点的HIF- 1α蛋白水平;D:在有无TET(20 μM)的情况下,用不同剂量辐射处理的H460细胞中HIF-1α蛋白的表达情况;E:在有无TET(20 μM)的情况下暴露于缺氧条件后,H460细胞中HIF-1α蛋白在不同时间点的表达情况;F:在有无TET(20 μM)处理后,H460细胞辐射后6 h或缺氧2 h时VEGF mRNA的水平;G、H:在常氧(G)和缺氧(H)下,有无TET预处理的辐射后VC和P53 H1299细胞的存活曲线;I:TET预处理对不同细胞系中辐射诱导的HIF-1α表达的影响;J:TET预处理对不同细胞系中缺氧诱导的HIF-1α表达的影响;VC:空白对照组
表 1 常氧下MCL预处理辐射后H1299和Calu-1细胞的存活曲线参数

表 2 缺氧下MCL预处理辐射后H1299和Calu-1细胞的存活曲线参数

表 3 常氧和缺氧条件下经TET预处理的H460细胞辐射后的存活曲线参数

表 4 常氧和缺氧条件下经TET预处理的辐射VC和p53 H1299细胞辐射后的存活曲线参数

-
[1] Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6):394-424. DOI: 10.3322/caac.21492
[2] Rafael M, Clare M, Jihyoun J, et al. Lung cancer incidence trends by gender, race and histology in the United States, 1973-2010[J]. PloS One, 2015, 10(3):e0121323. DOI: 10.1371/journal.pone.0121323
[3] Christos C, Olivier B, Michel A, et al. Targeted therapy for localized nonsmall cell lung cancer:a review[J]. Oncotargets Ther, 2016, 9:4099-4104. DOI: 10.2147/OTT.S104938
[4] Bristow RG, Alexander B, Baumann M, et al. Combining precision radiotherapy with molecular targeting and immunomodulatory agents:a guideline by the American Society for Radiation Oncology[J]. Lancet Oncol, 2018, 19:e240-e251. DOI: 10.1016/S1470-2045(18)30096-2
[5] Brown JM, Wilson WR. Exploiting tumour hypoxia in cancer treatment[J]. Nat Rev Cancer, 2004, 4(6):437-447. DOI: 10.1038/nrc1367
[6] Moeller BJ, Dewhirst MW. HIF-1 and tumor radiosensitivity[J]. Brit J Cancer, 2006, 95(1):1-5.
[7] Bhagya N, Chandrashekar KR. Tetrandrine-a molecule of wide bioactivity[J]. Phytochemistry, 2016:5-13. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=34d521a8483155290c77ae8c087d5326
[8] 肖韡, 洪梅.汉防己甲素对晚期非小细胞肺癌的放疗增敏作用[J].重庆医学, 2015, (24):3362-3364. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=cqyx201524018 [9] Koukourakis MI, Giatromanolaki A, Sivridis E, et al. Hypoxia-inducible factor (HIF1A and HIF2A), angiogenesis, and chemoradiotherapy outcome of squamous cell head-and-neck cancer[J]. Int J Radiat Oncol Bol Phys, 2002, 53:1192-1202. DOI: 10.1016/S0360-3016(02)02848-1
[10] Bachtiary B, Schindl M, Pötter R, et al. Overexpression of hypoxia-inducible factor 1α indicates diminished response to radiotherapy and unfavorable prognosis in patients receiving radical radiotherapy for cervical cancer[J]. Clin Cancer Res, 2003, 9:2234-2240. http://carcin.oxfordjournals.org/cgi/ijlink?linkType=ABST&journalCode=clincanres&resid=9/6/2234
[11] Zhang J, Zhu L, Fang J, et al. LRG1 modulates epithelial-mesenchymal transition and angiogenesis in colorectal cancer via HIF-1α activation[J]. J Exp Clin Canc Res, 2016, 35(1):1-11. DOI: 10.1186/s13046-015-0276-9
[12] Lee SY, Kim HJ, Oh SC, et al. Genipin inhibits the invasion and migration of colon cancer cells by the suppression of HIF-1α accumulation and VEGF expression[J]. Food Chem Toxicol, 2018, 116:70-76. DOI: 10.1016/j.fct.2018.04.005
[13] Wei J, Yang Y, Lu M, et al. Recent advances in the discovery of HIF-1α-p300/CBP inhibitors as anti-cancer agents[J]. Mini Rev Med Chem, 2018, 18(4):296-309.
[14] Zhuo C, Liang Z, Feng Z, et al. Tetrandrine suppresses lung cancer growth and induces apoptosis, potentially via the VEGF/HIF-1α/ICAM-1 signaling pathway[J]. Oncol Lett, 2018, 15(5):7433-7437.
[15] Zhang W, Xiong Z, Wei T, et al. Nuclear factor 90 promotes angiogenesis by regulating HIF-1α/VEGF-A expression through the PI3K/Akt signaling pathway in human cervical cancer[J]. Cell Death Dis, 2018, 9(3):276. DOI: 10.1038/s41419-018-0334-2
[16] Ma T, Yang S, Jing H, et al. Apparent diffusion coefficients in prostate cancer:correlation with molecular markers Ki-67, HIF-1α and VEGF[J]. Nmr Biomed, 2018:e3884. DOI: 10.1002/nbm.3884
[17] Miyasaka A, Oda K, Ikeda Y, et al. PI3K/mTOR pathway inhibition overcomes radioresistance via suppression of the HIF1-α/VEGF pathway in endometrial cancer[J]. Gynecol Oncol, 2015, 138(1):174-180. DOI: 10.1016/j.ygyno.2015.04.015
[18] Wang H, Zhang C, Xu L, et al. Bufalin suppresses hepatocellular carcinoma invasion and metastasis by targeting HIF-1α via the PI3K/AKT/mTOR pathway[J]. Oncotarget, 2016, 7(15):20193-20208. DOI: 10.18632/oncotarget.7935
[19] Xu X, You K, Bu R. Proximal tubular development is impaired with downregulation of MAPK/ERK signaling, HIF-1α, and catalase by hyperoxia exposure in neonatal rats[J]. Oxid Med Cell Longev, 2019, 2019:1-16. http://www.researchgate.net/publication/335469046_Proximal_Tubular_Development_Is_Impaired_with_Downregulation_of_MAPKERK_Signaling_HIF-1_a_and_Catalase_by_Hyperoxia_Exposure_in_Neonatal_Rats



 下载:
下载: