Therapeutic evaluation of multidisciplinary treatment for 71 cases of rhabdomyosarcoma in children
-
摘要:目的 评价横纹肌肉瘤(rhabdomyosarcoma,RMS)多学科诊疗草案重庆方案(CQ-RMS-2009)多学科综合治疗(multidisciplinary treatment,MDT)儿童RMS的有效性,探讨RMS预后因素。方法 回顾性分析2006年5月至2016年4月于上海交通大学医学院附属新华医院治疗、年龄 <14岁RMS患儿临床资料。比较不同因素对RMS患儿长期生存的影响。结果 71例RMS患儿纳入研究,男女比例1.84:1;中位诊断年龄为47(2~166)个月,中位随访时间52(15~165)个月。5年总体生存率(5-year overall survival,5y-OS)和5年无事件生存率(5-year event free survival,5y-EFS)分别为(61.9±5.1)%和(56.1±4.2)%。2006年5月至2009年12月收治的患儿5y-OS为(48.1±12.1)%,2010年1月至2016年4月收治患儿的5-OS为(73.3±7.9)%,差异具有统计学意义(P=0.042);5y-EFS分别为(35.9±11.7)%和(69.8±8.7)%,差异无统计学意义(P=0.064)。单因素分析显示,病理类型、术后临床分组、治疗模式、危险度分组是影响RMS患儿总体生存率(overall survival,OS)的重要因素(均P<0.05)。多因素分析显示,术后临床分组及治疗模式是影响患儿预后的独立因素(均P<0.05)。结论 当RMS确诊时,多数患儿处于中晚期,OS偏低,MDT模式可有效改善RMS患儿的预后,降低晚期患儿复发/疾病进展率,对于疾病复发/进展后的局部控制同样有明显效果。Abstract:Objective To explore the effectiveness and feasibility of multidisciplinary treatment (MDT) based on the CQ-RMS-2009 protocol and analyze the association of prognostic factors with the long-term survival of children with rhabdomyosarcoma (RMS).Methods Medical records of patients with RMS under 14 years of age at Xinhua Hospital, Shanghai Jiao Tong University School of Medicine, from May 2006 to April 2016 were analyzed. The association of different factors with the long-term survival of children with RMS was compared.Results In total, 71 cases of RMS in children were included. The male to female ratio was 1.84:1, median age at diagnosis was 47 (2-166) months, and median follow-up time was 52 (15-165) months. The 5-year overall survival (5y-OS) and 5-year event free survival (5y-EFS) was 61.9%±5.1% and 56.1%±4.2%. From May 2006 to December 2009 and from January 2009 to April 2016, the 5yOS was 48.1%±12.1% and 73.3%±7.9%, respectively (P=0.042), and the 5y-EFS was 35.9%±11.7% and 69.8%±8.7%, respectively (P=0.064). The univariate analysis showed that the pathological subtypes, postoperative clinical group (P=0.025), treatment patterns, and risk groups were significantly associated with overall survival (OS)(P<0.05). Multivariate analysis revealed that the postoperative clinical group and treatment patterns were independent prognostic factors (P<0.05).Conclusions On diagnosis, most of the children with RMS are already in the middle and late stages with low OS. MDT could effectively improve the prognosis and reduce the rate of relapse/progression in children with RMS, and it has remarkable efficacy for local control of disease relapse/progression.
-
Keywords:
- rhabdomyosarcoma (RMS) /
- multidisciplinary treatment (MDT) /
- prognosis /
- children
-
横纹肌肉瘤(rhabdomyosarcoma,RMS)是起源于原始间叶组织的恶性肿瘤,是儿童期最常见的软组织肉瘤,约占儿童所有恶性肿瘤的4.5%[1],发病率居儿童颅外实体肿瘤的第3位[2]。美国14岁以下儿童/青少年的RMS年发病率为4.5/100万例[3],50%以上患儿的发病年龄为1~10岁。美国自1972年成立了国际横纹肌肉瘤协作组(Intergroup Rhabdomyosarcoma Study Group,IRSG),对RMS进行了较为深入的研究。目前,RMS患儿5年总体生存率已达70%以上[4]。中国近年先后发布了一些区域性或全国性RMS诊断及治疗的建议或共识[5-6],但与发达国家存在一定的差距。本研究旨在分析71例RMS患儿的诊疗情况,进而评估多学科综合治疗(multidisciplinary treatment,MDT)模式对RMS的临床价值。
1. 材料与方法
1.1 一般资料
选取2006年5月至2016年4月上海交通大学医学院附属新华医院收治的RMS患儿,纳入标准:1)诊断时年龄 < 14岁;2)经手术切除或肿块活组织检查,病理确诊为RMS的初诊患儿;3)至少完成1个化疗疗程。剔除确诊后非疾病进展而放弃治疗的6例患儿,71例随访资料完整的RMS患儿纳入本研究。
1.2 方法
1.2.1 诊断方法
所有患儿的手术或活检组织的病理切片均经2位病理科医师审核,明确诊断为RMS。依据2013年世界卫生组织制定的RMS病理学诊断及分型标准[7],横纹肌肉瘤分为4个亚型:胚胎型横纹肌肉瘤、腺泡型横纹肌肉瘤、多形性横纹肌肉瘤和梭形/硬化型横纹肌肉瘤。儿童多形性横纹肌肉瘤罕见,约占儿童横纹肌肉瘤的1%,鉴于此亚型罕见,本组病例中无此亚型,即分为胚胎型、腺泡型和梭形细胞/硬化型3个亚型。2014年9月之后收治的RMS患儿均同步采用免疫荧光标记的原位杂交技术(fluorescence in situ hybridization,FISH)检测FOXO1基因易位情况。所有患儿治疗前均需行相关的影像学检查(包括B超、放射性核素骨扫描、电子计算机断层扫描、磁共振成像、正电子发计算机断层显像等)和骨髓穿刺;若肿瘤原发或转移至眼眶、中耳、鼻腔、鼻咽、颞下窝、翼腭、咽旁区等脑脊膜旁区域,进行脑脊液检查。根据IRSG制定的分期标准对患儿进行治疗前分期[8]。根据患儿接受全身治疗前的手术情况进行术后临床分组(包括术后肿瘤的残留状态、淋巴结受累情况等),分为Ⅰ~Ⅳ组[9]。按照IRSG制定的RMS危险度分组标准[10],将患儿划分为不同的危险度,给予相应的治疗方案。
1.2.2 疗效评估
参考实体肿瘤疗效评定标准对RMS患儿进行疗效评定[11]。完全缓解(complete remission,CR)指接受治疗的患儿,经体格检查及CT或磁共振检查提示肿瘤完全消失。部分缓解(partial remission,PR)指肿瘤最大直径缩小≥50%,无任何新发或疾病进展的证据。疾病稳定(stable disease,SD)指肿瘤最大直径缩小<50%,无任何新发或疾病进展的证据。疾病进展(progressive disease,PD)指肿瘤最大直径增大≥25%,或有新发肿瘤;对于PR患儿,肿瘤增大>50%,亦定义为疾病进展。复发指已获得CR的患儿出现新发肿瘤病灶或原发部位的肿瘤重新出现。
1.2.3 治疗方案
1)化疗:2006年5月至2009年12月收治的RMS患儿接受以AVCP/IEV/VCP/DEV为主(阿霉素30 mg/m2 d1、8,长春新碱1.5 mg/m2 d0、7,环磷酰胺300 mg/m2 d1~3,顺铂90 mg/m2 d0/异环磷酰胺1.5 g/m2 d1~5,依托泊苷100 mg/m2 d1~5,长春新碱1.5 mg/m2 d0、7/长春新碱1.5 mg/m2 d0、7,环磷酰胺300 mg/m2 d1~3,顺铂90 mg/m2 d0/更生霉素12 μg/kg d1~5,依托泊苷100 mg/m2 d1~5,长春新碱1.5 mg/ m 2 d0、7)的化疗方案,中危组CR后4个疗程及高危组CR后6个疗程,总疗程≤14个[12]。2010年1月至2016年4月收治的患儿采用中国儿童肿瘤协作组(Chinese Children's Cancer Group,CCCG)RMS多学科诊疗草案重庆方案(CQ-RMS-2009)进行治疗。通常在术后7 d开始化疗,为VAC方案(长春新碱1.5 mg/m2 d1、8、15,放线菌素D 0.045 μg/kg d1,环磷酰胺1.8 g/m2 d1),放疗期间停用放线菌素D,低危RMS应用VAC和VA(长春新碱+放线菌素D)方案,共12个疗程;中危及高危组RMS应用VAC共14个疗程。
2)手术:根据治疗前的影像学评估肿瘤可完整切除者,先行手术,再行化疗及局部放疗;若完整切除困难者,则仅行肿块活检,明确诊断后先行新辅助化疗,再行放疗或择期手术。手术治疗总的原则是完整切除原发病灶和周边1~2 cm未受侵犯的边缘正常组织,尽可能地保留器官、肢体功能,不影响美观。
3)放疗:适用于原发肿瘤部位术后残留病灶(镜下残留或肉眼残留)、转移部位和受累的区域淋巴结,放射剂量取决于残留病灶数量。术后镜下残留(Ⅱ期)、区域淋巴结未侵犯的患儿放疗剂量为40 Gy,已有淋巴结受累的剂量为45 Gy;有肉眼残留(Ⅲ期)者剂量为40~50 Gy,放疗过程中每周给予静脉注射长春新碱进行化疗。
1.2.4 随访
统计终点为末次随访时间、复发、死亡或失访。总生存期(overall survival,OS)为确诊之日至末次随访日期(2020年1月),或任何原因所致死亡的时间。无事件生存期(event free survival,EFS)为确诊之日至事件发生的时间,该事件指疾病进展、复发、失访、放弃治疗及死亡。失访指完成化疗后1年内无任何形式的随访记录,失访患儿生存期计算至末次随访日,以末次随访疗效作为疾病最终状态。
1.3 统计学分析
采用SPSS 17.0软件进行统计学分析。采用Kaplan-Meier法计算生存率,定性资料以率(%)表示。采用对数秩检验(Log-rank检验)单因素分析其预后危险因素,多因素分析采用Cox回归模型,定性资料采用χ2检验。以P< 0.05为差异具有统计学意义。
2. 结果
2.1 临床特征
纳入的71例RMS患儿中,男性46例,女性25例,男女比例为1.84:1。诊断年龄 < 1岁5例(7.0%),1~4岁32例(45.1%),5~9岁28例(39.4%),≥10岁6例(8.5%)。中位诊断年龄为47(2~166)个月,中位随访时间为52(15~165)个月。
肿瘤原发部位:四肢/躯干20例(28.2%),头颈部(非脑膜旁)13例(18.3%),脑膜旁12例(16.9%),眼眶部1例(1.4%),盆腔11例(15.5%),膀胱/前列腺9例(12.7%),泌尿生殖道(非膀胱/前列腺)3例(4.2%)(会阴1例、输尿管1例、子宫/阴道壁1例),胆道2例(2.8%)。首发症状多见于局部非外伤性肿块,其次是因肿块增大造成的功能障碍:无痛性肿物32例(45.1%),腹痛、腹胀12例(16.9%),鼻塞伴涕中带血6例(8.5%),局部疼痛7例(9.8%),排尿或排便困难9例(12.7%),头痛、头晕或视力下降3例(4.2%),发热、黄疸2例(2.8%)。
根据IRSG制定的RMS治疗前分期标准,71例患儿分为1期7例(9.9%),2期15例(21.1%),3期23例(32.4%),4期26例(36.6%)。术后临床分组:Ⅰ组3例(4.2%),Ⅱ组10例(14.1%),Ⅲ组32例(45.1%),Ⅳ组26例(36.6%)。RMS危险度分组:低危组2例(2.8%),中危组44例(62.0%),高危组25例(35.2%)。
初诊时24例(33.8%,24/71)出现远处转移,其中肺转移6例(25.0%,6/24),淋巴结转移4例(16.7%,4/ 24),骨骼转移3例(12.5%,3/24)。71例患儿中,病理组织学类型为胚胎型横纹肌肉瘤46例(64.8%),腺泡型横纹肌肉瘤20例(28.2%),梭形/硬化型横纹肌肉瘤5例(7.0%)。2014年9月后收治的26例RMS患儿(胚胎型15例,腺泡型9例,梭形/硬化型2例),经FISH技术检测FOXO1基因易位,发现6例(22.2%,6/ 27)为FOXO1基因易位阳型,且均为腺泡型RMS。该6例中有5例诊断时已存在远处转移,截至末次随访;4例死亡,1例化疗/放疗及手术后仍未达CR,家属放弃治疗。另外1例原发部位为上唇部,虽无远处转移,但经4个疗程评估,肿块无明显缩小,并根据体外药敏实验结果调整治疗方案,治疗中行2次手术及放疗,治疗难度较大。
2.2 生存评估
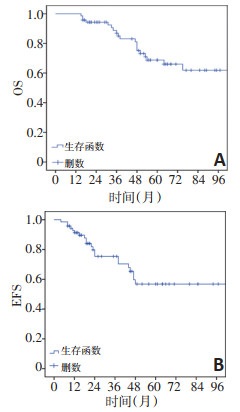
患儿5年总体生存率(5-year overall survival,5y-OS)和5年无事件生存率(5-year event free survival,5y-EFS)分别为(61.9±5.1)%和(56.1±4.2)%(图 1)。其中2006年5月至2009年12月收治的RMS患儿(18例)5y-OS为(48.1±12.1)%,2010年1月至2016年4月收治的患儿(53例)5y-OS为(73.3±7.9)%,差异具有统计学意义(P= 0.042);2006年5月至2009年12月与2010年1月至2016年4月收治的患儿5y-EFS分别为(35.9±11.7)%和(69.8± 8.7)%,差异无统计学意义(P=0.064)。
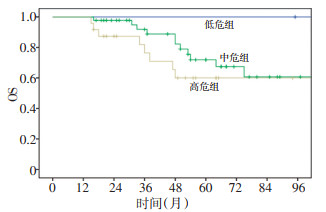
71例RMS患儿按照危险度分组比较:低危组、中危组及高危组5y-OS分别为100%、(67.4±8.7)%和(45.2± 13.5)%,差异具有统计学意义(P=0.035,图 2)。
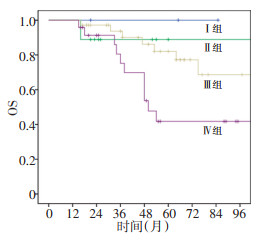
71例RMS患儿按照术后临床分组比较:Ⅰ~Ⅳ组的5y-OS分别为100%、(88.9±10.5)%、(77.2±8.4)%和(41.8±11.6)%,差异具有统计学意义(P=0.025,图 3)。
71例RMS患儿中,有29例(40.8%)出现复发/疾病进展,中位复发/疾病进展时间为确诊后17(5~55)个月。复发/疾病进展后3y-OS为(30.1 ± 10.7)%。2006年5月至2009年12月出现复发/疾病进展患儿11例(15.5%),占同期患儿总数的61.1%(11/18)。其中8例(44.4%,8/18)为术后临床分组Ⅳ组的患儿,平均复发/疾病进展进展时间为确诊后21(10~50)个月:2例复发/疾病进展后行自体干细胞移植,1例行个体化方案治疗(CTX+TOPO),2例再次给予局部放疗或病灶手术切除术,3例出现转移后放弃治疗;8例患儿死亡。2010年1月至2016年4月出现复发/疾病进展患儿18例(25.3%),占同期患儿总数的11.9%(18/53)。此18例均为术后临床分组Ⅳ组的患儿。平均复发/疾病进展时间为确诊后31(10~48)个月,其中8例复发/疾病进展后死亡。
2.3 放疗和化疗相关并发症
患儿化疗后常见不良反应为骨髓抑制、电解质紊乱、药物相关不良反应。根据NCI-CTC 2.0评估标准[11],应用VAC方案患儿中15例(15/53,28.3%)骨髓抑制达到4级,存在粒细胞缺乏患儿给予粒细胞集落刺激因子对症治疗,血常规均恢复正常,无患儿因化疗后骨髓抑制导致延迟治疗或死亡。3例患儿治疗过程中发生严重呕吐导致低钠血症,引起惊厥。3例患儿出现药物相关性不良反应,其中1例患儿应用伊立替康后1周出现延迟性腹泻,1例患儿应用长春新碱后出现周围型神经炎(手指僵硬),1例患儿化疗后出现严重肝功能损害,保肝治疗后肝功能恢复正常。71例患儿中仅3例放疗部位发育受影响,1例出现放疗后听力受损。
2.4 影响RMS预后的相关危险因素
将71例患儿的发病年龄、性别、原发部位、病理类型、治疗前分期、术后临床分组、危险度分组、肿瘤大小、治疗模式进行单因素分析(表 1)。结果显示,病理类型、术后临床分组、危险度分组、治疗模式是影响患儿OS的重要因素(均P < 0.05)。采用Cox回归模型对上述影响因素进行多因素分析(表 2)。结果显示,术后临床分组及治疗模式(P=0.032)是影响患儿预后的独立因素(均P < 0.05);术后临床分组级别高、未进行MDT规范治疗的患儿预后较差。
表 1 71例RMS患儿临床特征及生存分析 表 2 影响RMS患儿预后的多因素分析
表 2 影响RMS患儿预后的多因素分析
3. 讨论
RMS可发生于人体各部位,包括骨骼肌部位以及没有骨骼肌的部位(如膀胱、阴道等),最常见发病部位为头颈部和泌尿生殖道,其次为四肢、躯干、腹膜后等,少见部位为胆管、肺、大网膜等[13-14]。本组病例中发病部位以头颈部最多,其中(非脑膜旁)13例(18.3%),脑膜旁12例(16.9%),眼眶1例(1.4%),其次是四肢/躯干20例(28.2%)。Fischer等[15]研究显示,儿童RMS以胚胎型最常见,其次为腺泡型,男性发病率较女性高。本研究病理类型以胚胎型最多见,男性发病率较高,与国外报道[16-17]相似。初诊时有24例(33.8%)出现远处转移,其中以肺转移最多(6例),与Rudzinski等[17]报道的最常见的转移部位相同。
有研究[18]证实,RMS的某些细胞遗传学及分子生物学标志可影响患儿的长期生存率,其中FOXO1基因染色体易位被公认是影响RMS预后的分子生物学因素之一,在RMS诊断及分型、个体化治疗及治疗后评估方面有重要价值。60%~70%腺泡型患儿存在t(2;13)(q35;q14)染色体易位形成PAX3/FOXO1融合基因,该类患儿5y-OS仅为22%,约10%的腺泡型患儿存在t(1;13)(q36;q14)染色体易位形成PAX7/FOXO1融合基因,此类融合基因阳性患儿5y-OS约为75%。其余腺泡型无上述2种融合基因的患儿的发病部位、转移发生率、生存率、基因表达信号等与胚胎型RMS患儿无显著性差异[19]。可见,PAX/ FOXO1融合基因检测在RMS危险度分组及预后评估方面起重要作用。最新美国儿童肿瘤协作组(Children's Oncology Group,COG)研究[20]结果提示,对PAX3/PAX7-FOXO1融合基因阳性患儿,应提高治疗强度。相反,融合基因阴性患儿应减轻治疗强度。目前,中国尚无大样本数据分析该融合基因的治疗效果及预后。因检测方法有限,本组病例只能检测到是否存在FOXO1易位,未能统计具体融合基因。本研究结果显示,6例FOXO1阳性患儿治疗效果及生存情况均较差。随着检测方法的进步,未来该项检测在RMS的诊断及危险度分型、指导个体化治疗和预后评估方面有重要的指导意义,且一些肿瘤的靶向药物已经在实验室检查中发现,尽管尚未转化为临床,此类患儿有望找到较好的治疗方法[21]。
国内对于RMS的临床特征及治疗效果的认识主要来自国际大型临床数据研究,尤其是IRSG、欧洲儿童软组织肉瘤研究组(European Pediatric Soft Tissue Sarcoma,EpSSG)、国际儿童肿瘤协会(International Society of Pediatric Oncology,SIOP)等。近年随着手术技术的改进、化疗方案的优化、局部放疗的介入等综合治疗方法的应用,国际上儿童RMS的长期生存率已达70%以上[10, 22],而发展中国家RMS患儿的生存率明显低于发达国家[23-24]。中国儿童RMS的诊治缺乏大样本、多中心、随机对照的临床研究及长期随访资料。国内报道的RMS患儿长期生存率低于国际上报道,5y-OS不足65%[25-27]。本研究病例按照与年代相关的治疗模式不同划分,2006年5月至2009年12月收治的18例患儿未经MDT治疗,其5y-OS为(48.1±12.1)%;2010年1月至2016年4月收治的患儿经过小儿血液/肿瘤科、小儿肿瘤外科、肿瘤放疗科、病理科、医学影像科、核医学科多学科规范治疗,其5y-OS达(73.3±7.9)%。2006年5月至2009年12月出现复发/疾病进展者为11例(15.5%),占同期收治患儿总数的61.1%(11/18);2010年1月至2016年4月出现复发/疾病进展者为18例(25.3%),占同期收治患儿总数的11.9%(18/53)。该结果显示,接受MDT治疗的患儿5y-OS高于未接受MDT治疗的患儿,前者的复发/疾病进展率较后者明显下降。但是,由于本研究随访时间相对较短,且为单中心资料,还需要进一步延长随访时间,扩大样本进行深入研究。
Rudzinski等[17]研究结果显示存在远处转移患儿的5y-OS约40%,对远处转移部位行手术或放疗进行局部控制可以明显提高患儿生存率[28-29]。本研究中,术后临床分组为Ⅳ组的患儿共26例(36.6%),其5yOS为(41.8±11.6)%。2006年5月至2009年12月共8例(44.4%,8/18)为Ⅳ期患儿,均出现复发/疾病进展,其中仅2例出现复发/疾病进展后行局部放疗或病灶手术切除术;截至末次随访,8例患儿均死亡。2010年1月至2016年4月共18例(33.9%,18/53)患儿临床分期为Ⅳ期,截至末次随访,共8例出现复发/疾病进展,其中4例死亡。本院2010年之后收治的患儿中存在远处转移者,均会进一步行手术或放疗进行局部控制,这也是本组患儿诊断时有远处转移者生存率与国外研究结果相近[28-29]的原因。该结果表明,MDT不仅降低晚期患儿的复发/疾病进展率,对于疾病复发/进展后的局部控制也有明显效果。
目前,欧美等发达国家RMS的治疗效果已经达到“瓶颈”,总体生存率难再提高[30]。中国儿童RMS的总体预后与国际先进水平尚有一定差距,本组病例中,初诊时临床分组为Ⅳ组患儿26例(36.6%),29例(40.8%)患儿出现复发/疾病进展,其3y-OS为(30.1±10.7)%。RMS恶性程度高、复发/进展率高、就诊时出现远处转移比例高,导致中国RMS患儿生存率较低。如何早期发现并提高晚期RMS患儿生存率,已经成为国内外RMS研究协作组的研究重点。中国儿童RMS瘤治疗与国际上存在差距的主要原因:RMS发病率低,临床医师对RMS认识不足,易造成漏诊或延误治疗;患儿在专科医院就诊时已进入肿瘤晚期;目前,国内多数医院无独立的儿童肿瘤病区,且各学科之间缺少协作,MDT团队极少。因此,需要发展中国儿童肿瘤专科医院诊治RMS的水平,及时、准确、多学科协作规范治疗,强化患儿管理,进行多中心临床研究,开展多种分子遗传学异常的检查,通过MDT治疗策略的应用进一步提高中国儿童RMS的整体治疗水平。
-
表 1 71例RMS患儿临床特征及生存分析

表 2 影响RMS患儿预后的多因素分析

-
[1] Dasgupta R, Fuchs J, Rodeberg D. Rhabdomyosarcoma[J]. Semin Pediatr Surg, 2016, 25(5):276-283. DOI: 10.1053/j.sempedsurg.2016.09.011
[2] Shern JF, Yohe ME, Khan J. Pediatric rhabdomyosarcoma[J]. Crit Rev Oncog, 2015, 20(3-4):227-243. DOI: 10.1615/CritRevOncog.2015013800
[3] Ognjanovic S, Linabery AM, Charbonneau B, et al. Trends in childhood rhabdomyosarcoma incidence and survival in the United States, 1975-2005[J]. Cancer, 2009, 115(18):4218-4226. DOI: 10.1002/cncr.24465
[4] Smith MA, Altekruse SF, Adamson PC, et al. Declining childhood and adolescent cancer mortality[J]. Cancer, 2014, 120(16):2497-2506. DOI: 10.1002/cncr.28748
[5] 汤静燕, 潘慈, 徐敏, 等.儿童横纹肌肉瘤"上海儿童医学中心Rs-99方案"临床报告[J].中国实用儿科杂志, 2003, 18(4):208-211. DOI: 10.3969/j.issn.1005-2224.2003.04.009 [6] 中国抗癌协会小儿肿瘤专业委员会, 中华医学会儿科学分会血液学组, 中华医学会小儿外科学分会肿瘤组: 中国儿童及青少年横纹肌肉瘤诊疗建议(CCCG-RMS-2016)[J].中华儿科杂志, 2017, 55(10): 724-728. [7] Jo VY, Fletcher CD. WHO classification of soft tissue tumours:an update based on the 2013(4th) edition[J]. Pathology, 2014, 46(2):95-104. DOI: 10.1097/PAT.0000000000000050
[8] Lawrence W, Anderson JR, Gehan EA, et al. Pretreatment TNM staging of childhood rhabdomyosarcoma:a report of the Intergroup Rhabdomyosarcoma Study Group. Children's Cancer Study Group. Pediatric Oncology Group[J]. Cancer, 1997, 80(6):1165-1170. DOI: 10.1002/(SICI)1097-0142(19970915)80:6<1165::AID-CNCR21>3.0.CO;2-5
[9] Maurer HM, Gehan EA, Beltangady M, et al. The Intergroup Rhabdomyosarcoma Study-Ⅱ[J]. Cancer, 1993, 71(5):1904-1922. DOI: 10.1002/1097-0142(19930301)71:5<1904::AID-CNCR2820710530>3.0.CO;2-X
[10] Sangkhathat S. Current management of pediatric soft tissue sarcomas[J]. World J Clin Pediatr, 2015, 4(4):94-105. DOI: 10.5409/wjcp.v4.i4.94
[11] Eisenhauer EA, Therasse P, Bogaerts J, et al. New response evaluation criteria in solid tumours:revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2):228-247. DOI: 10.1016/j.ejca.2008.10.026
[12] Crist W, Gehan EA, Ragab AH, et al. The third intergroup rhabdomyosarcoma study[J]. J Clin Oncol, 1995, 13(3):610-630. DOI: 10.1200/JCO.1995.13.3.610
[13] Panda SP, Chinnaswamy G, Vora T, et al. Diagnosis and management of rhabdomyosarcoma in children and adolescents:ICMR consensus document[J]. Indian J Pediatr, 2017, 849(5):393-402.
[14] Skapek SX, Ferrari A, Gupta AA, et al. Rhabdomyosarcoma[J]. Nat Rev Dis Primers, 2019, 5(1):1.
[15] Fischer TD, Gaitonde SG, Bandera BC, et al. Pediatric-protocol of multimodal therapy is associated with improved survival in AYAs and adults with rhabdomyosarcoma[J]. Surgery, 2018, 163(2):324-329. DOI: 10.1016/j.surg.2017.10.027
[16] Hendricks M, Parkes J, Pillay K, et al. Outcomes of children with rhabdomyosarcoma treated with intensive chemotherapy, surgery, and radiotherapy through a period of protocol revision at a South African center, 1990-2010[J]. Pediatr Blood Cancer, 2017, 64(3):10.
[17] Rudzinski ER, Anderson JR, Chi YY, et al. Histology, fusion status, and outcome in metastatic rhabdomyosarcoma:a report from the Children's Oncology Group[J]. Pediatr Blood Cancer, 2017, 64(12):10.
[18] Hibbitts E, Chi YY, Hawkins DS, et al. Refinement of risk stratification for childhood rhabdomyosarcoma using FOXO1 fusion status in addition to established clinical outcome predictors:A report from the Children's Oncology Group[J]. Cancer Med, 2019, 8(14):6437-6448. DOI: 10.1002/cam4.2504
[19] Kazanowska B, Reich A, Stegmaier S, et al. Pax3-fkhr and pax7-fkhr fusion genes impact outcome of alveolar rhabdomyosarcoma in children[J]. Fetal Pediatr Pathol, 2007, 26(1):17-31. DOI: 10.1080/15513810701394702
[20] Gallego S, Zanetti I, Orbach D, et al. Fusion status in patients with lymph node-positive (N1) alveolar rhabdomyosarcoma is a powerful predictor of prognosis:Experience of the European Paediatric Soft Tissue Sarcoma Study Group (EpSSG)[J]. Cancer, 2018, 124(15):3201-3209. DOI: 10.1002/cncr.31553
[21] Yohe ME, Heske CM, Stewart E, et al. Insights into pediatric rhabdomyosarcoma research:challenges and goals[J]. Pediatr Blood Cancer, 2019, 66(10):e27869.
[22] Borinstein SC, Steppan D, Hayashi M, et al. Consensus and controversies regarding the treatment of rhabdomyosarcoma[J]. Pediatr Blood Cancer, 2018, 65(2):10.
[23] Antillon F, Castellanos M, Valverde P, et al. Treating pediatric soft tissue sarcomas in a country with limited resources:the experience of the Unidad Nacional de Oncologia Pediatrica in Guatemala[J]. Pediatr Blood Cancer, 2008, 51(6):760-764. DOI: 10.1002/pbc.21699
[24] Bansal D, Das A, Trehan A, et al. Pediatric rhabdomyosarcoma in india:a single-center experience[J]. Indian Pediatr, 2017, 54(9):735-738. DOI: 10.1007/s13312-017-1164-5
[25] 李艳华, 杨静薇, 廖雪莲, 等.儿童横纹肌肉瘤分层化疗疗效及生存因素分析[J].同济大学学报(医学版), 2020, 41(3):373-377. [26] 苗真, 王娴静, 孙静, 等.儿童横纹肌肉瘤17例病例分析[J].中国小儿血液与肿瘤杂志, 2017, 22(3):159-163. DOI: 10.3969/j.issn.1673-5323.2017.03.009 [27] 徐娜, 段超, 金眉, 等.单中心多学科联合诊治儿童横纹肌肉瘤的临床及预后分析[J].中华儿科杂志, 2019, 57(10):767-773. DOI: 10.3760/cma.j.issn.0578-1310.2019.10.008 [28] Doyen J, Jazmati D, Geismar D, et al. Outcome and patterns of relapse in childhood parameningeal rhabdomyosarcoma treated with proton beam therapy[J]. Int J Radiat Oncol Biol Phys, 2019, 105(5):1043-1054. DOI: 10.1016/j.ijrobp.2019.08.005
[29] Mohan AC, Venkatramani R, Okcu MF, et al. Local therapy to distant metastatic sites in stage Ⅳ rhabdomyosarcoma[J]. Pediatr Blood Cancer, 2018, 65(2):10.
[30] Mohan AC, Venkatramani R, Okcu MF, et al. Local therapy to distant metastatic sites in stage Ⅳ rhabdomyosarcoma[J]. Pediatr Blood Cancer, 2018, 65(2):10.
-
期刊类型引用(5)
1. 杨璐,程敬亮,高而远,张勇. 头颈部横纹肌肉瘤的临床及CT、MRI分析. 中国CT和MRI杂志. 2025(03): 33-35 .  百度学术
百度学术
2. 裴家鑫,吕新全,周雅淑,苏彦威,路太英. 横纹肌肉瘤组织Ki-67表达与临床病理特征及预后的关系. 中华实用诊断与治疗杂志. 2024(07): 674-678 .  百度学术
百度学术
3. 秦玲,李道明. 腺泡状横纹肌肉瘤41例临床病理特征及预后分析. 临床与实验病理学杂志. 2023(07): 822-828 .  百度学术
百度学术
4. 刘斯琴,叶芳华,范宸颖,彭敏,董佳佳,邓文军,张辉,俞燕,杨良春. 20例横纹肌肉瘤患儿的临床特点及预后分析. 中国当代儿科杂志. 2022(09): 1036-1041 .  百度学术
百度学术
5. 吴泽霖,卫凤桂,梁铭,关镜明,钟帼钰,邹亚伟,陈德晖. 基于问题的学习结合多学科诊疗在儿科住院医生规范化培训中的应用. 中国当代医药. 2021(22): 235-238 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: