Correlation of EGFR mutation status with metabolic parameters on 18F-FDG PET/CT in patients with advanced non-small cell lung cancer and its influence on prognosis
-
摘要:目的 探讨晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者18F-FDG PET/CT代谢参数及临床资料与表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变状态的相关性。同时探究EGFR基因突变状态对PET/CT代谢参数评估晚期NSCLC患者预后的影响。方法 回顾性分析2017年1月至2018年12月在重庆医科大学附属第一医院接受18F-FDG PET/CT检查并有EGFR基因突变检测结果 的109例晚期NSCLC患者。根据患者EGFR基因检测结果 分为EGFR突变型组(n=48)与EGFR野生型组(n=61),比较两组间PET/CT代谢参数及临床信息的差异并分析其与EGFR突变状态的关系。随访患者的无进展生存(progression free survival,PFS)状态,分析EGFR突变状态对PET/CT代谢参数评估PFS的影响。结果 多因素Logistic分析发现,女性(OR=12.154,P < 0.001)、腺癌(OR=4.822,P=0.019)、低最大标准摄取值(maximum standardized uptake value,SUVmax)(≤9.58,OR=4.347,P=0.005)是EGFR突变的独立预测因子。ROC生存曲线分析肿瘤代谢体积(metabolic tumor volume,MTV)(AUC= 0.749,P=0.000 2),糖酵解总量(total lesion glycolysis,TLG)(AUC=0.747,P=0.000 3)对患者的PFS状态具有预测价值。Cox回归分析发现,在EGFR基因突变型组中,MTV>14.85的患者疾病进展风险更高(HR=2.724,P=0.004);EGFR野生型组中,MTV>12.48的患者疾病进展风险更高(HR=3.195,P=0.002)。结论 对于晚期NSCLC患者,EGFR突变与更低的FDG摄取相关,体积代谢参数具有重要的预后预测价值,但对于EGFR基因突变不同状态,可以考虑不同的标准。
-
关键词:
- 正电子发射计算机断层显像 /
- 非小细胞肺癌表皮生 /
- 长因子受体
Abstract:Objective To assess the correlation between metabolic parameters on 18F-fluorodeoxyglucose positron emission tomography/ computed tomography (18F-FDG PET/CT) and the mutation status of the epidermal growth factor receptor (EGFR) gene in patients with advanced non-small-cell lung cancer (NSCLC) and to investigate the effect of EGFR mutation status on assessment of the prognosis based on metabolic parameters.Methods A total of 109 patients with advanced NSCLC who underwent both 18F-FDG PET/CT and EGFR mutation status evaluation at The First Affiliated Hospital of Chongqing Medical University between January 2017 and December 2018 were retrospectively analyzed. The patients were assigned into the EGFR mutant and EGFR wild-type groups according to their EGFR mutation status. Metabolic parameters and clinical information were compared between the two groups, and their relationship with EGFR mutation status were analyzed. The progression-free survival (PFS) of these patients was record to analyze the influence of EGFR mutation status on prognosis, as predicted using 18F-FDG PET/CT findings.Results Multivariate Logistic analysis demonstrated that female sex (OR=12.154, P < 0.001), adenocarcinoma (OR=4.822, P=0.019), and a maximum standardized uptake value (SUVmax) ≤9.58 (OR=4.347, P=0.005) were correlated with the presence of EGFR mutations. The receiver operating characteristic curves of PFS illustrated that metabolic tumor volume (MTV) (AUC=0.749, P=0.000 2) and total lesion glycolysis (TLG) (AUC=0.747, P=0.0003) could be used to evaluate the prognosis of NSCLC patients. According to the results of Cox regression analysis, patients with an MTV>14.85 (HR=2.724, P=0.004) in the EGFR mutant group and patients with an MTV>12.48 (HR=3.195, P=0.002) in the EGFR wild-type group had a higher risk of disease progression.Conclusions EGFR mutations in advanced NSCLC patients are associated with low 18F-FDG uptake, and volumetric parameters are of great significance in the prediction of prognosis. However, different evaluation criteria using 18F-FDG PET/CT parameters should be adopted for evaluating the prognosis of patients with different types of EGFR mutations. -
非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌最常见的组织学类型,约占所有肺癌的85%[1]。随着个体化精准治疗的发展,NSCLC的治疗除常规的手术、放化疗之外,针对肿瘤恶性表型分子的靶向治疗也逐渐被应用于临床。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,EGFR-TKIs)能够阻断EGFR的信号传导,进而影响肿瘤细胞增殖分化,对EGFR突变阳性的NSCLC患者有着良好的治疗效果[2-3]。使用EGFR-TKIs前需要明确肿瘤组织EGFR基因的突变状态,检测方法主要是DNA测序,标本可以是肿瘤组织、胸水肿瘤细胞、外周循环肿瘤细胞等。但这种方法具有一定的局限性,如部分标本采集困难、存在采样误差、因各种原因导致的样本无法使用、检测时间偏长等,这也限制了EGFRTKIs在临床的应用。
有研究表明,EGFR基因可以通过NOX4/ROS/ GLUT1轴影响肿瘤的糖代谢[4],18F-FDG PET/CT可以通过检测肿瘤细胞18F-FDG的摄取了解肿瘤的糖代谢情况,因此是否可以将18F-FDG PET/CT作为一种评估EGFR基因状态的无创、快速的手段成为临床关注的重点。此外,18F-FDG PET/CT在NSCLC的预后评估中发挥着重要作用[5],EGFR基因突变状态是否对18F-FDG PET/CT用于NSCLC预后评估造成影响有待研究。本研究对就诊于重庆医科大学附属第一医院的晚期NSCLC患者资料进行回顾性分析,旨在了解患者EGFR突变状态与18F-FDG PET/CT代谢参数的相关性及其对预后评估的影响。
1. 材料与方法
1.1 一般资料
回顾性分析2017年1月到2018年12月于重庆医科大学附属第一医院行18F-FDG PET/CT检查的晚期(临床Ⅲ~Ⅳ期)NSCLC患者。纳入标准:1)行病理组织EGFR基因检测;2)需在初次接受治疗前28天以内行18F-FDG PET/CT检查;3)临床信息完整;4)临床分期Ⅲ~Ⅳ期。排除标准:1)合并其他恶性肿瘤;2)接受抗肿瘤治疗后再进行PET/CT或基因检测;3)糖尿病患者;4)原发病灶直径 < 1 cm(排除部分容积效应的影响)。收集的信息包括:年龄、性别、吸烟史、原发病灶最长径、TNM分期、血清癌胚抗原(car⁃ cinoembryonic antigen,CEA)值、18F-FDG PET/CT相关代谢参数。本研究将“吸烟者”定义为每日吸烟1支以上或每周吸烟超过4次,连续3个月及以上,或者行18F-FDG PET/CT前吸烟数量累计≥100支[6],其余则被定义为“未吸烟者”。TNM分期按照国际肺癌肿瘤协会(IASLC)第8版TNM肺癌分期标准判定,对于未获得病理检测结果的淋巴结转移病灶和远处转移病灶,以影像学表现结合患者的临床资料为评定标准。
1.2 方法
1.2.1 18F-FDG PET/CT图像获取
采用Philips Gemini TF 64 PET/CT检测系统;18F-FDG由重庆医科大学附属第一医院核医学科医用回旋加速器生产,放化纯度>95%。检查前患者空腹6 h以上,空腹血糖≤6.1 mmol/L。静脉注射18F-FDG显像剂,剂量3.70~5.55 MBq/kg体质量,安静休息1 h后行PET/CT显像,扫描范围为颅顶至大腿根部。CT扫描参数:电压120 kV,电流100 mA,层厚4.0 mm;PET扫描参数:4D采集,层厚4.0 mm,头颈部扫描5 min/床位,头颈部以下部位3 min/床位。CT数据采用衰减校正,迭代法重建图像,获得冠状位、矢状位、轴位图像传至EBW工作站。
1.2.2 图像分析
由1名专业的核医学医师对图像进行判读,对于原发病灶,以最大标准摄取值(maximum standardized uptake value,SUVmax)=2.5为阈值,在PET/CT融合图像上自动勾画感兴趣区,再对各层按原发病灶肿瘤轮廓逐层进行手动修改。由机器自动测量感兴趣区的SUVmax、平均标准摄取值(mean standardized uptake value,SUVmean)、肿瘤代谢体积(metabolic tumor volume,MTV)。在肝脏右叶连续三个层面以直径6 cm勾画感兴趣区(避开肝门区和囊肿),得到3个肝脏SUVmean,取平均值即为SUV肝血池。在主动脉弓连续三个层面以直径3 cm勾画感兴趣区,得到3个纵隔血池的SUVmean,取平均值即为SUV纵隔血池。用原发病灶SUVmax分别除以SUV肝及纵隔血池,即可得到SUVtumor/liver、SUVtumor/ mediastinum[7]。糖酵解总量(total lesion glycolysis,TLG)通过公式TLG=MTV×SUVmean计算。
1.2.3 病例随访
随访方式为医院信息管理系统联合电话随访。观察事件为无进展生存期(progression free survival,PFS),定义为患者从进行PET/CT扫描的第1天到疾病进展、死亡或随访终止的时间,本研究的末次随访时间为2020年4月30日。疾病进展标准:随访明确提示观察的肿瘤病灶增大>20%或者出现新的病灶。
1.3 统计学分析
采用SPSS 25.0、Medcalc 19.0.7、Graphpad Prism 8.3.0软件进行统计学分析。分类变量用χ2检验,数值变量用t检验或非参数检验,相关性分析采用二元Logistic回归,分析EGFR突变的独立预测因子。对于无进展生存状态的生存分析,采用绘制ROC生存曲线分析代谢参数的最佳截断值,运用Kaplan-Meier曲线及Cox回归评估代谢参数对生存状态的预测价值。以P < 0.05为差异具有统计学意义。
2. 结果
2.1 患者的一般临床资料
符合纳入标准的患者共109例(男性61例,女性48例),其中48例(44.0%)患者EGFR突变阳性,61例(56.0%)患者EGFR基因突变状态为野生型。EGFR突变更容易发生在女性患者(72.9% vs. 21.3%,P < 0.001)。109例患者初次诊断为肺癌的平均年龄是(61.57±11.13)岁,且突变型组及野生型组之间年龄的差异无统计学意义。57例患者有吸烟史,不吸烟的患者比吸烟的患者更容易发生EGFR突变(67.3% vs. 22.8%,P < 0.001)。本研究发现腺癌患者更容易发生EGFR突变(52.4% vs. 18.5%,P=0.002)。此外,比较两组肿瘤的TNM分期、临床分期、血清CEA值、肿瘤最长径等临床信息,除N分期(P=0.016)外,其余指标组间差异均无统计学意义。患者EGFR基因突变状态与一般临床资料的具体情况见表 1。
表 1 患者临床特征与EGFR基因突变的关系
2.2 18F-FDG PET/CT代谢参数与EGFR基因突变状态的相关性
对比EGFR突变型组及野生型组的PET/CT代谢参数(表 2),发现EGFR突变型组SUVmax(8.71 vs. 10.75,P=0.003)、SUVtumor/liver(4.52 vs. 6.45,P=0.003)、SUVtumor/mediastinum(4.39 vs. 5.90,P=0.019)、TLG(80.35 vs. 258.06,P=0.001)、MTV(16.00 vs. 46.66,P=0.001)均较EGFR野生型组低,且组间差异具有统计学意义,而SUVmean组间差异无统计学意义[(4.67±2.39)vs.(5.05± 1.47),P=0.302]。
表 2 PET/CT代谢参数与EGFR基因突变的关系
2.3 EGFR基因突变的影响因素
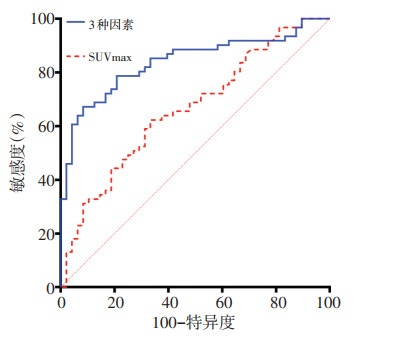
在PET/CT相关代谢参数关于EGFR突变的诊断效能的ROC曲线分析中,SUVmax、SUVmean、SUVtumor/liver、SUVtumor/mediastinum、MTV和TLG的最佳截断值分别为9.58、5.08、5.13、10.14、37.76和283.08,对应的曲线下面积(AUC)分别为0.664、0.664、0.631、0.686、0.684。再分别以最佳截断值对代谢参数分组。单因素分析结果显示性别、吸烟史、CEA值、病理组织类型、低SUVmax(≤9.58)、低SUVmean(≤ 5.08)、低SUVtumor/liver(≤5.13)、低SUVtumor/mediastinum(≤10.14)、低MTV(≤37.76)、低TLG(≤283.08)与EGFR突变相关。多因素分析结果显示,女性(OR= 12.154,P < 0.001)、腺癌(OR=4.822,P=0.019)、低SUVmax(≤9.58,OR=4.347,P=0.005)是预测EGFR突变的独立影响因子(表 3)。此外还探究了联合3个独立影响因子预测EGFR突变状态的ROC曲线(图 1),结果显示AUC为0.840。
表 3 单、多因素Logistic分析参数与EGFR基因突变的关系
2.4 18F-FDG PET/CT各代谢参数预测晚期NSCLC患者PFS的价值
本次患者的平均随访时间为(11.39±8.27)个月,最长随访时间为35个月,截至最后一次随访,发生进展的患者有92例。预测PFS状态的ROC曲线显示SUVmax(AUC=0.649,P=0.059 5),SUVmean(AUC=0.596,P= 0.222 5),SUVtumor/liver(AUC=0.643,P=0.064 1),SUVtumor/mediastinum(AUC=0.637,P=0.100 7),MTV(AUC=0.749,P=0.000 2),TLG(AUC=0.747,P=0.000 3)的预测PFS状态的最佳截断值分别为5.80、4.55、3.84、5.73、14.85、75.13。以最佳截断值分组发现所有参数的组间Kaplan-Meier生存曲线差异具有统计学意义(表 4)。
表 4 18F-FDG PET/CT代谢参数预测晚期NSCLC患者的PFS状态及Kaplan-Meier生存分析
2.5 EGFR基因突变状态对PET/CT代谢参数评估预后的影响
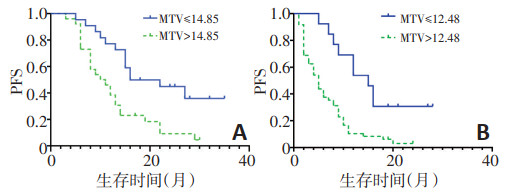
对突变型组及野生型组患者分别行ROC生存状态分析,得到两组各个参数预测PFS状态的最佳截断值(表 5)。Cox单因素回归分析显示,在EGFR突变组中,所有纳入研究的代谢参数均具有预测PFS的价值,其中体积参数MTV拥有最大的风险比。在EGFR野生型组中,仅有MTV、TLG能够预测PFS的价值。分别将各组有统计学意义的参数进行多因素Cox回归,发现两组均仅MTV具有预测PFS的价值。纳入Cox回归方程结果显示,在EGFR突变型组中,MTV> 14.85患者的疾病进展风险更高,风险比为2.724(95%CI:1.371~5.415,P=0.004,图 2)。在EGFR野生型组中,MTV>12.48患者的疾病进展风险更高,风险比为3.195(95%CI:1.536~6.646,P=0.002,图 2)。
表 5 根据EGFR不同突变状态分组PET/CT代谢参数的预后评估价值
3. 讨论
18F-FDG PET/CT作为一种全身检查手段,不仅可以了解NSCLC病灶的位置、大小等形态学特征,而且还与肿瘤细胞的许多分子生物学特征相关,包括病理组织类型、葡萄糖转运蛋白1(glucose transporter type1,GLUT1)的表达、乏氧状态等[8]。EGFR基因及其表达的产物可以通过影响多条信号传导通路,如RAS/RAF/MAPK通路、PI3K/AKT通路等,影响肿瘤的生物学特征[9]。NOX4基因编码的蛋白质可充当氧传导器,催化分子氧转化为活性氧(reactive oxygen species,ROS),ROS可参与GLUT1的表达,有研究发现EGFR突变的NSCLC细胞株中NOX4基因、GLUT1表达水平降低,ROS活性降低,提出了EFGR基因可能会通过NOX4/ROS/GLUT1轴影响FDG的摄取[4, 10-11]。
本研究探讨了EGFR突变状态与18F-FDG PET/ CT相关代谢参数(SUVmax、SUVmean、SUVtumor/liver、SUVtumor/mediastinum、TLG、MTV)及部分临床资料的相关性。发现EGFR突变型组的所有参数均低于EGFR野生型组。此外,本研究还联合了患者的部分临床资料,多因素Logistic分析发现女性、腺癌、低SUVmax(≤9.58)可以作为预测晚期NSCLC患者EGFR突变的独立影响因子。联合这3种因素的EGFR突变状态ROC曲线AUC为0.840。
既往研究中,SUVmax与EGFR突变状态的关系存在一定的争议。Lv等[12]研究发现,低SUVmax(< 7.0)的NSCLC患者更容易发生EGFR基因突变,Gao等[13]进行多因素Logistic分析发现,低SUVmax(≤ 11.5)是EGFR基因突变的独立预测因子之一。但也有部分研究发现SUVmax与EGFR突变状态没有明显的相关性[14-15],造成这种差异多是由于实验方案的设计不同,例如选取的样本多为单中心研究,不同人种驱动基因突变谱之间有一定差异,研究的纳入、排除标准不一致等,同时SUVmax还会受到采集时间、图像的采集方式及重建模式的影响。本研究发现EGFR突变与更低的FDG摄取相关,并且结合临床资料可以更好的评估晚期NSCLC患者的EGFR突变状态,这将有助于患者EGFR-TKIs靶向治疗的选择。
多项研究表明18F-FDG PET/CT代谢参数在NSCLC的预后评估中具有一定价值[16]。单独的SUVmax仅表现了肿瘤病灶的最高代谢摄取,难以反映肿瘤空间特征与生物学行为,相较而言,体积代谢参数MTV、TLG将肿瘤的体积与代谢两方面信息结合,可以反映病灶的肿瘤负荷,具有更好的预后评估价值[17-19]。本研究探讨了18F-FDG PET/CT代谢参数对晚期NSCLC患者PFS的预测价值,ROC生存曲线分析发现,MTV、TLG的诊断效能优于SUV。为了解代谢参数对预后的评估价值是否会受到EGFR突变状态的影响,本研究分别分析了EGFR突变型组及野生型组代谢参数的预后评估效能,多因素Cox回归分析发现两组均只有MTV为预测预后状态的独立因子,但两组MTV的最佳截断值与高MTV的风险比均不同。
本研究存在一定的局限性,第一,本研究为单中心回顾性研究,选择均为住院患者,可能存在一定的选择偏倚;第二,尽管纳入患者的治疗方式多按照标准的临床指南,并且由于临床分期相近,疾病的管理方案相差不大,但治疗方式的异质性仍会对治疗结果造成影响;第三,由于晚期NSCLC患者大多未进行手术及淋巴结清扫,临床信息收集到的TNM分期并非病理确诊的TNM分期,多是通过影像学方法进行的TNM分期,存在隐匿性淋巴结的可能性;第四,因为在随访期内死亡的人数不多并且随访时间偏短,所以仅分析了患者PFS,未进行总生存期的分析;第五,由于本研究样本中ALK及ROS基因融合突变的病例数很少,故未分析ALK及ROS基因融合突变的影响。
综上所述,本研究发现EGFR突变可能与更低的FDG摄取相关。女性患者、病理组织类型为腺癌、SUVmax≤9.58是EGFR突变的独立预测因子。18F-FDG PET/CT体积代谢参数在预测晚期NSCLC患者的PFS上具有良好的预测效能。但是,由于EGFR状态可能会影响肿瘤细胞的代谢,因此在使用体积代谢参数评估晚期NSCLC患者预后时,可以考虑使用不同的评估标准。未来仍需进一步进行多中心、前瞻性的研究来探讨EGFR突变与18F-FDG PET/CT代谢参数的关系,并制定合适的预后评估标准。
-
表 1 患者临床特征与EGFR基因突变的关系

表 2 PET/CT代谢参数与EGFR基因突变的关系

表 3 单、多因素Logistic分析参数与EGFR基因突变的关系

表 4 18F-FDG PET/CT代谢参数预测晚期NSCLC患者的PFS状态及Kaplan-Meier生存分析

表 5 根据EGFR不同突变状态分组PET/CT代谢参数的预后评估价值

-
[1] Travis WD, Brambilla E, Nicholson AG, et al. The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification[J]. J Thorac Oncol, 2015, 10(9): 1243-1260. DOI: 10.1097/JTO.0000000000000630
[2] Kris MG, Johnson BE, Berry LD, et al. Using multiplexed assays of oncogenic drivers in lung cancers to select targeted drugs[J]. JAMA, 2014, 311(19): 1998-2006. DOI: 10.1001/jama.2014.3741
[3] 李佳琦, 姚艳艳, 滕玉双, 等. 表皮生长因子受体酪氨酸激酶抑制剂研究进展[J]. 国际药学研究杂志, 2019, 46(1): 1-9. https://www.cnki.com.cn/Article/CJFDTOTAL-GWYZ201901001.htm [4] Chen L, Zhou Y, Tang X, et al. EGFR mutation decreases FDG uptake in nonsmall cell lung cancer via the NOX4/ROS/GLUT1 axis[J]. Int J Oncol, 2019, 54(1): 370-380. http://www.ncbi.nlm.nih.gov/pubmed/30431083
[5] Kitajima K, DoiH, Kanda T, et al. Present and future roles of FDGPET/CT imaging in the management of lung cancer[J]. Jpn J Radiol, 2016, 34(6): 387-399. DOI: 10.1007/s11604-016-0546-2
[6] 秦娟, 浦跃朴, 杜伟, 等. 食管鳞状细胞癌患者吸烟史与食管支架置入术预后的关系[J]. 环境与职业医学, 2020, 37(10): 981-987. https://www.cnki.com.cn/Article/CJFDTOTAL-LDYX202010009.htm [7] Kuo WH, Wu YC, Wu CY, et al. Node/aorta and node/liver SUV ratios from (18)F- FDG PET/CT may improve the detection of occult mediastinal lymph node metastases in patients with non-small cell lung carcinoma[J]. Acad Radiol, 2012, 19(6): 685-692. DOI: 10.1016/j.acra.2012.02.013
[8] Jadvar H, Alavi A, Gambhir SS. 18F-FDG uptake in lung, breast, and colon cancers: molecular biology correlates and disease characterization[J]. J Nucl Med, 2009, 50(11): 1820-1827. DOI: 10.2967/jnumed.108.054098
[9] Carcereny E, Morán T, Capdevila L, et al. The epidermal growth factor receptor (EGRF) in lung cancer[J]. Transl Respir Med, 2015, 3: 1. DOI: 10.1186/s40247-015-0013-z
[10] Jafari N, Kim H, Park R, et al. CRISPR-Cas9 mediated NOX4 knockout inhibits cell proliferation and invasion in hela cells[J]. PLoS One, 2017, 12(1): e0170327. DOI: 10.1371/journal.pone.0170327
[11] Crosas- Molist E, Bertran E, Rodriguez- Hernandez I, et al. The NADPH oxidase NOX4 represses epithelial to amoeboid transition and efficient tumour dissemination[J]. Oncogene, 2017, 36(21): 3002-3014. DOI: 10.1038/onc.2016.454
[12] Lv Z, Fan J, Xu J, et al. Value of F- FDG PET/CT for predicting EGFR mutations and positive ALK expression in patients with non-small cell lung cancer: a retrospective analysis of 849 Chinese patients[J]. Eur J Nucl Med Mol Imaging, 2018, 45(5): 735-750. DOI: 10.1007/s00259-017-3885-z
[13] Gao XC, Wei CH, Zhang RG, et al. F-FDG PET/CT SUV and serum CEA levels as predictors for EGFR mutation state in Chinese patients with non-small cell lung cancer[J]. Oncol Lett, 2020, 20(4): 61. http://www.researchgate.net/publication/343293968_18F-FDG_PETCT_SUVmax_and_serum_CEA_levels_as_predictors_for_EGFR_mutation_state_in_Chinese_patients_with_non-small_cell_lung_cancer
[14] Lee SM, Bae SK, Jung SJ, et al. FDG uptake in non-small cell lung cancer is not an independent predictor of EGFR or KRAS mutation status: a retrospective analysis of 206 patients[J]. Clin Nucl Med, 2015, 40(12): 950-958. DOI: 10.1097/RLU.0000000000000975
[15] Zhu L, Yin G, Chen W, et al. Correlation between EGFR mutation status and F -fluorodeoxyglucose positron emission tomography-computed tomography image features in lung adenocarcinoma[J]. Thorac Cancer, 2019, 10(4): 659-664. DOI: 10.1111/1759-7714.12981
[16] 陈挺, 张宏, 田梅. 18F-FDGPET/CT代谢半定量参数在非小细胞肺癌预后评估中的价值[J]. 国际放射医学核医学杂, 2018, 42(3): 269- 273. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=gwyx-fsyxhyxfc201803014 [17] Sharma A, Mohan A, Bhalla AS, et al. Role of various metabolic parameters derived from baseline 18F-FDG PET/CT as prognostic markers in non- small cell lung cancer patients undergoing platinumbased chemotherapy[J]. Clin Nucl Med, 2018, 43(1): e8-e17. DOI: 10.1097/RLU.0000000000001886
[18] Chardin D, Paquet M, Schiappa R, et al. Baseline metabolic tumor volume as a strong predictive and prognostic biomarker in patients with non-small cell lung cancer treated with PD1 inhibitors: a prospective study[J]. J Immunother Cancer, 2020, 8(2): e00645. http://www.researchgate.net/publication/343185444_Baseline_metabolic_tumor_volume_as_a_strong_predictive_and_prognostic_biomarker_in_patients_with_non-small_cell_lung_cancer_treated_with_PD1_inhibitors_a_prospective_study
[19] Hong IK, Lee JM, Hwang IK, et al. EGFRDiagnostic and predictive values of F- FDG PET/CT metabolic parameters in-mutated advanced lung adenocarcinoma[J]. Cancer Manag Res, 2020, 12: 6453-6465. DOI: 10.2147/CMAR.S259055
-
期刊类型引用(6)
1. 徐飞,彭向前,徐天才,熊义问. ~(18)F-FDG PET/CT显像联合PSMA检测对前列腺癌诊断的应用价值. 中国CT和MRI杂志. 2024(01): 124-126 .  百度学术
百度学术
2. 满都花,庄翔,徐佳欢,吴鹏飞,初超,金海蛟,张强. EGFR基因突变与非小细胞肺癌CT影像组学特征的相关性研究. 中国卫生标准管理. 2024(08): 105-109 .  百度学术
百度学术
3. 雍伟,姚佳,刘平. PET/CT在直肠癌术后放化疗患者癌灶远端转移诊断及预后评估中的应用. 分子影像学杂志. 2023(05): 895-899 .  百度学术
百度学术
4. 李珅,王璐,孙艺珊,辛军. PET/CT代谢参数及临床特征用于诊断非小细胞肺癌表皮生长因子受体基因突变. 中国医学影像技术. 2022(05): 703-707 .  百度学术
百度学术
5. 刘华,杨培,蒋祥德,程刚,张华鹏,陈方. 吉非替尼对晚期非小细胞肺癌患者化疗中癌胚抗原、CYFRA21-1及CA125表达水平的影响. 临床和实验医学杂志. 2022(11): 1141-1144 .  百度学术
百度学术
6. 王玉成,陈小宇. 64排CT扫描结合血清学检查在非小细胞性肺癌纵隔淋巴结转移诊断中的应用效果. 影像研究与医学应用. 2022(14): 53-55 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: