-
摘要: 铁死亡是近年来新发现的一种程序性细胞死亡形式,其特征是脂质活性氧的铁依赖性堆积,并在乳腺癌等疾病中起着重要的作用。乳腺癌是女性常见的恶性肿瘤之一,虽其病因及发病机制尚未阐明,但通过激活铁死亡途径能抑制乳腺癌细胞增殖,改善对化疗药物的耐药性,增强对放疗的敏感性及抑制癌细胞远处转移,可作为乳腺癌患者治疗的潜在新靶点。本文将对铁死亡发生机制及在乳腺癌治疗中的作用进行综述。Abstract: Ferroptosis, a recently discovered form of programmed cell death characterized by iron-dependent accumulation of lipid reactive oxygen species, plays an important role in diseases such as breast cancer. Although breast cancer is a common malignant tumor in women, its etiology and pathogenesis remain unclear. However, activation of the ferroptosis pathway is known to affect breast cancer cells by inhibiting their proliferation, mitigating their resistance to chemotherapy drugs, enhancing their sensitivity to radiotherapy, and inhibiting their distant metastases; thus, the ferroptosis pathway is a potential novel target for the treatment of breast cancer. Herein, we summarize the mechanisms of ferroptosis and its potential role in breast cancer treatment.
-
Keywords:
- ferroptosis /
- breast cancer /
- treatment /
- reactive oxygen species
-
近年来,研究发现铁死亡(ferroptosis)是一种不同于细胞凋亡、焦亡和坏死的程序性细胞死亡,以铁依赖性脂质活性氧(lipid reactive oxygen species,LipROS)堆积造成的细胞死亡为特征[1-2]。铁死亡在肿瘤、神经系统和心血管系统等疾病中起着重要的作用,并可通过调控铁死亡来干预这些疾病的进展[3],因此铁死亡成为近年来的研究热点。
乳腺癌是威胁女性健康的恶性肿瘤之一,化疗药物耐药是影响乳腺癌疗效的重要因素。通过诱导癌细胞死亡是癌症治疗的常见策略,铁死亡作为一种新型细胞死亡形式,在乳腺癌治疗中具有重要作用[4]。本文将对铁死亡发生机制及在乳腺癌治疗中的作用进行综述。
1. 铁死亡概述
1.1 铁在铁死亡中的作用
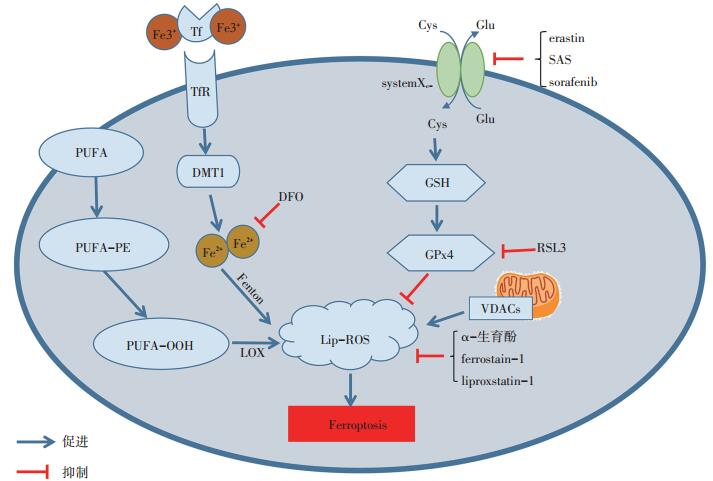
铁作为铁死亡的催化剂或调控因子,导致铁催化的Fenton反应产生的Lip-ROS直接损伤细胞引起程序性细胞死亡[5]。因此,铁离子螯合剂去铁胺(deferoxamine,DFO)和亲脂性抗氧化剂α-生育酚可以逆转Lip-ROS堆积引起的细胞死亡。
1.2 铁死亡的特征
铁死亡与其他已确定的细胞死亡方式不同,具有其独特的形态学和生化特征[1],形态学特征主要是线粒体皱缩、线粒体嵴减少或消失、线粒体膜密度增加、线粒体膜破裂及细胞核形态正常,但缺乏染色质凝集等[6]。生化特征主要是铁和Lip-ROS水平的升高以及谷胱甘肽(glutathione,GSH)耗竭、谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)失活、线粒体膜电位降低等[2]。
1.3 铁死亡发生机制
在细胞发生铁死亡的过程中,细胞膜上的多不饱和脂肪酸(PUFA)在酯氧合酶(lipoxygenase,LOX)和铁的催化下产生Lip-ROS,而Lip-ROS的清除主要由GPX4完成[7]。当胱氨酸谷氨酸反向转运体(cystine/glutamate antiport),又称systemXc-被抑制时,阻碍胱氨酸(cystine,Cys)向细胞内导入,减少合成GSH所必需的半胱氨酸,GSH合成受阻导致GSH依赖性GPX4失活,造成细胞内Lip-ROS堆积,从而引起细胞的氧化性损伤[1, 6]。因此,抑制systemXc-、GSH耗竭和GPX4失活成为诱导细胞发生铁死亡的关键环节。
systemXc-是调节铁死亡过程中的重要靶点,研究表明erastin、柳氮磺胺吡啶(sulfasalazine,SAS)、索拉非尼(sorafenib)能与相关的转运蛋白结合,阻断systemXc-的转运功能,诱导细胞死亡[8-9]。而丁硫氨酸-亚砜亚胺则能直接抑制GSH合成,导致GSH依赖性酶GPX4失活,使细胞内的Lip-ROS不能被GPX4所清除,堆积在细胞内造成细胞氧化性损伤[10]。小分子化合物RSL3可直接与GPX4共价键结合使GPX4失活,导致细胞内Lip-ROS堆积,驱动细胞程序性铁死亡[11]。此外,由erastin、SAS诱导的细胞死亡能被铁死亡抑制剂ferrostatin-1[12]、liproxstatin-1[13]所逆转。研究提示,通过调节铁死亡发生机制及使用相关诱导剂和抑制剂可达到调控肿瘤细胞生长的作用(图 1)[14]。
2. 铁死亡与肿瘤的关系
铁死亡在调节某些类型肿瘤细胞(如胰腺导管细胞癌、肝细胞癌等)的生长中起着不可忽视的作用,探索铁死亡相关调节机制在肿瘤中的作用对于肿瘤的认识与治疗均有较大的意义。
目前,大多数化疗药物是通过诱导肿瘤细胞凋亡而起作用,若发生肿瘤细胞凋亡逃逸则产生化疗耐药性,克服化疗耐药性是亟待解决的问题。作为一种新型程序性细胞死亡,铁死亡具有独特的特征,通过使用铁死亡诱导剂及抑制剂(表 1)在肿瘤的治疗中显示出巨大的潜力[14]。激活铁死亡途径后能诱导癌细胞死亡[15],特别是在耐药的情况下增强对化疗药物的敏感性,如顺铂联合铁死亡诱导剂erastin能显著地改善抗肿瘤活性,显示出铁死亡在肿瘤治疗中的重要性[16]。研究表明,铁死亡可作为肿瘤抑制的新靶点,为临床肿瘤的治疗开辟新途径[10]。
表 1 铁死亡相关诱导剂和抑制剂
3. 铁死亡与乳腺癌相关性研究
3.1 铁死亡的抑癌作用
癌细胞表现出异常的氨基酸代谢和对特定氨基酸的依赖性,这可能给癌症患者的治疗提供潜在的靶点。Chen等[17]研究发现,三阴性乳腺癌(triple negative breast cancer,TNBC)细胞中Cys缺乏时具有高致死性,DFO和ferrostatin-1可阻碍因Cys缺乏引起的细胞死亡,提示Cys缺乏时可诱导TNBC细胞发生铁死亡。此外,喻浩宸等[18]研究发现,SAS通过抑制systemXc-的功能性亚基xCT蛋白和GPX4蛋白的表达及促进二价金属离子转运体1(divalent metal transporter 1,DMT1)的表达,使乳腺癌ZR-75-1细胞中活性氧大量堆积,从而触发细胞发生铁死亡。
3.2 参与协同抗癌作用
Ma等[19]研究发现,西拉美新和拉帕替尼具有协同诱导乳腺癌MDA-MB-231、MCF-7、ZR-75和SKBr3细胞系发生死亡,其死亡机制和细胞内产生的Lip-ROS及FeCl3的水平升高相关,并且ferrostatin-1和DFO能逆转由西拉美新和拉帕替尼引起的细胞死亡。该研究亦发现单独使用拉帕替尼或联合西拉美新使用后,降低铁转运蛋白的表达,减少铁输出到细胞外;同时增加转铁蛋白的表达,促进铁运输到细胞内,使细胞内含铁量增多,催化铁依赖性Lip-ROS产生。当过表达铁转运蛋白或沉默转铁蛋白表达时,可减少细胞内Lip-ROS的产生和细胞死亡,表明西拉美新和拉帕替尼的协同抗癌作用是通过铁死亡途径发挥作用。
3.3 增强放疗敏感性
铁饱和型乳铁蛋白(holo-lactoferrin,Holo-Lf)是乳铁蛋白的一种铁饱和形式,能增强erastin诱导MDA-MB-231细胞发生铁死亡及增强细胞对放疗的敏感性。Zhang等[20]研究发现,Holo-Lf能抑制MDAMB-231细胞活力,联合erastin可进一步抑制细胞活力,细胞中碘化丙啶(propidium iodide,PI)荧光值增高和Lip-ROS产生增多;相反缺铁型乳铁蛋白(apolacto ferrin,Apo-Lf)则显著降低MDA-MB-231细胞中PI荧光值,并减少Lip-ROS的生成。该研究还发现,Holo-Lf能显著下调MDA-MB-231和MCF-7细胞中的GPX4表达,而Apo-Lf则显著上调该2种细胞中的GPX4表达。Holo-Lf联合放疗剂量4 Gy处理MDA-MB-231细胞,可使Lip-ROS生成显著增高,表明放疗能促进细胞发生铁死亡,增强放疗敏感性。
3.4 抑制远处转移
远处转移和复发是乳腺癌死亡的主要原因[21],脑转移是HER-2阳性乳腺癌的独立危险因素,HER-2靶向治疗可延长HER-2阳性乳腺癌患者的生存期,但由于化疗药物的耐药性及药物穿过血脑屏障的渗透性有限,多达50%患者的脑转移无法治愈。酪氨酸激酶抑制剂来那替尼(neratinib)是治疗HER-2阳性乳腺癌患者的重要药物[22]。Nagpal等[23]研究发现,HER-2高表达的TBCP-1细胞株移植裸鼠后,能引起较高的自发性脑和其他器官转移,体外使用来那替尼能显著诱导细胞的死亡。该研究进一步发现,来那替尼诱导的是非凋亡方式死亡,并且这种死亡方式能被铁死亡抑制剂liproxstatin-1逆转,而凋亡抑制剂Q-VD则不能阻止来那替尼诱导的细胞死亡,表明来那替尼是通过铁死亡途径诱导TBCP-1细胞的死亡。同时来那替尼能显著抑制裸鼠肿瘤的生长和肝、肺及脑的转移,并证明与触发铁死亡途径密切相关。
3.5 联合外泌体增强抗癌作用
在癌症治疗中,外泌体的靶向性和生物相容性具有独特的优势,增加抗癌药物向肿瘤靶向递送的能力。Yu等[24]研究发现,使用叶酸(folate,FA)标记载有erastin的外泌体(erastin@FA-exo)能特异性靶向FA受体过表达的TNBC细胞,erastin@FA-exo与游离的erastin相比对MDA-MB-231细胞的增殖和迁移具有显著抑制作用,并通过作用于GSH抑制GPX4表达,导致Lip-ROS堆积而触发细胞发生铁死亡。
3.6 其他
小分子诱导的铁死亡对肿瘤的生长具有抑制作用,并能增强对化疗药物的敏感性。xCT是systemXc-的功能性亚基,负责细胞内谷氨酸和细胞外Cys的转换,对TNBC细胞的存活至关重要。黏蛋白1C末端亚基(mucin 1-C,MUC1-C)跨膜癌蛋白在TNBC细胞中异常高表达,与xCT相结合维持GSH的氧化还原平衡。Hasegawa等[25]研究发现,TNBC细胞中沉默MUC1-C表达后导致xCT表达下调,使GSH水平失衡,从而诱导活性氧介导的细胞死亡,并且铁死亡抑制剂ferrostatin-1能逆转沉默MUC1-C表达导致的细胞死亡。该研究还发现,沉默MUC1-C表达的TNBC细胞,暴露于多柔比星中对erastin诱导的细胞死亡更敏感,充分说明MUC1-C具有抗铁死亡作用。因此,靶向作用MUC1-C/xCT途径可能成为诱导TNBC细胞死亡的潜在治疗方法。
4. 结语
近年来,铁死亡作为肿瘤的研究热点之一,在杀死多种肿瘤细胞中发挥重要的作用。基于铁死亡的肿瘤治疗新靶点,对启发设计治疗肿瘤新药物的策略具有重要意义。乳腺癌的病因尚未完全清楚,铁死亡在乳腺癌细胞的死亡中扮演了重要的角色,而外泌体在药物与靶点之间的信息传递中具有较好的作用,若能将治疗药物和铁死亡诱导剂同时包装在外泌体内,靶向乳腺癌细胞可有效克服治疗的局限性。目前,乳腺癌发生铁死亡的研究主要集中于体外细胞水平,为临床应用提供了相关的理论依据,探索基于铁死亡的有效肿瘤治疗新策略具有广阔的前景。
-
表 1 铁死亡相关诱导剂和抑制剂

-
[1] Cao JY, Dixon SJ. Mechanisms of ferroptosis[J]. Cell Mol Life Sci, 2016, 73(11-12):2195-2209. http://cn.bing.com/academic/profile?id=922423f5dc9c1439bc69ddf5513ac405&encoded=0&v=paper_preview&mkt=zh-cn
[2] Latunde-Dada GO. Ferroptosis:role of lipid peroxidation, iron and ferritinophagy[J]. Biochim Biophys Acta Gen Subi, 2017, 1861(8):1893-1900. http://d.old.wanfangdata.com.cn/Periodical/sjkxjs-zyxdh201806003
[3] Li J, Cao F, Yin HL, et al. Ferroptosis:past, present and future[J]. Cell Death Dis, 2020, 11(2):88. http://d.old.wanfangdata.com.cn/Periodical/sjkxjs-zyxdh201806003
[4] Nedeljković M, Damjanović A. Mechanisms of chemotherapy resistance in triple-negative breast cancer-how we can rise to the challenge[J]. Cells, 2019, 8(9):E957. http://cn.bing.com/academic/profile?id=1d2756951c7c2b590fcbd4af43359338&encoded=0&v=paper_preview&mkt=zh-cn
[5] Wang S, Luo J, Zhang Z, et al. Iron and magnetic:new research direction of the ferroptosis-based cancer therapy[J]. Am J Cancer Res, 2018, 8(10):1933-1946. http://cn.bing.com/academic/profile?id=2154f73c2606ce2942e989ca59c8fbed&encoded=0&v=paper_preview&mkt=zh-cn
[6] Xie Y, Hou W, Song X, et al. Ferroptosis:process and function[J]. Cell Death Differ, 2016, 23(3):369-379. http://d.old.wanfangdata.com.cn/Periodical/sjkxjs-zyxdh201806003
[7] Yang WS, Kim KJ, Gaschler MM, et al. Peroxidation of polyunsaturated fatty acids by lipoxygenases drives ferroptosis[J]. Proc Natl Acad Sci U S A, 2016, 113(34):E4966-4975. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=cb9c25048d1a4d590e6cdac9190f4750
[8] Lachaier E, Louandre C, Godin C, et al. Sorafenib induces ferroptosis in human cancer cell lines originating from different solid tumors[J]. Anticancer Res, 2014, 34(11):6417-6422. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=1f9ac5737e5099441858b90dce5619ff
[9] Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis:an irondependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5):1060-1072. http://d.old.wanfangdata.com.cn/Periodical/sjkxjs-zyxdh201806003
[10] Lu B, Chen XB, Ying MD, et al. The role of ferroptosis in cancer development and treatment response[J]. Front Pharmacol, 2018, 8:992. https://xueshu.baidu.com/usercenter/paper/show?paperid=44903c5895cb177fe1baafd22f60db8b&site=xueshu_se
[11] Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2):317-331. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=fa300eafe2cca6efc9abc70d7098bb4c
[12] Miotto G, Rossetto M, Di Paolo ML, et al. Insight into the mechanism of ferroptosis inhibition by ferrostatin-1[J]. Redox Biol, 2020, 28:101328. http://cn.bing.com/academic/profile?id=af3260ed3e8799d6e961b41afde7dfa0&encoded=0&v=paper_preview&mkt=zh-cn
[13] Sheng X, Shan C, Liu J, et al. Theoretical insight into the mechanism of ferroptosis suppression via inactivation of lipid peroxide radical by liproxstatin-1[J]. Phys Chem Chem Phys, 2017, 19(20):13153-13159. https://pubs.rsc.org/en/content/articlelanding/2017/cp/c7cp00804j
[14] Xu T, Ding W, Ji X, et al. Molecular mechanisms of ferroptosis and its role in cancer therapy[J]. J Cell Mol Med, 2019, 23(8):4900-4912. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1111/jcmm.14511
[15] Yu H, Guo P, Xie X, et al. Ferroptosis, a new form of cell death, and its relationships with tumourous diseases[J]. J Cell Mol Med, 2017, 21(4):648-657. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=10.1111/jcmm.13008
[16] Sato M, Kusumi R, Hamashima S, et al. The ferroptosis inducer erastin irreversibly inhibits system xc- and synergizes with cisplatin to increase cisplatin's cytotoxicity in cancer cells[J]. Sci Rep, 2018, 8(1):968. http://www.ncbi.nlm.nih.gov/pubmed/29343855
[17] Chen MS, Wang SF, Hsu CY, et al. CHAC1 degradation of glutathione enhances cystine-starvation-induced necroptosis and ferroptosis in human triple negative breast cancer cells via the GCN2-eIF2α-ATF4 pathway[J]. Oncotarget, 2017, 8(70):114588-114602. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5777716/
[18] 喻浩宸, 陈锐, 郭世朋, 等.柳氮磺吡啶诱导乳腺癌ZR-75-1细胞发生铁死亡及其机制研究[J].肿瘤, 2018, 38(10):933-941. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zl201810003 [19] Ma S, Henson ES, Chen Y, et al. Ferroptosis is induced following siramesine and lapatinib treatment of breast cancer cells[J]. Cell Death Dis, 2016, 7:e2307. http://cn.bing.com/academic/profile?id=b1833562a4acf4c5278ebcc44af55fa6&encoded=0&v=paper_preview&mkt=zh-cn
[20] Zhang Z, Xu J, Qin LQ, et al. The valuable role of holo-lactoferrin in ferroptosis and its application in radiotherapy of triple negative breast cancer (P05-014-19)[J]. Curr Dev Nutr, 2019, 3(Suppl 1):31224151 DOI: 10.1093/cdn/nzz030.P05-014-19/5517761
[21] 徐兵河, 王树森, 江泽飞, 等.中国晚期乳腺癌维持治疗专家共识[J].中华普通外科学文献(电子版), 2018, 12(1):1-5. http://d.old.wanfangdata.com.cn/Periodical/zhyx201802003 [22] 杨艳芳, 姜战胜, 顾林.HER-2阳性乳腺癌治疗的研究进展[J].中国肿瘤生物治疗杂志, 2018, 25(11):1200-1204. [23] Nagpal A, Redvers RP, Ling X, et al. Neoadjuvant neratinib promotes ferroptosis and inhibits brain metastasis in a novel syngeneic model of spontaneous HER2+ve breast cancer metastasis[J]. Breast Cancer Res, 2019, 21(1):94. https://www.researchgate.net/publication/335156205_Neoadjuvant_neratinib_promotes_ferroptosis_and_inhibits_brain_metastasis_in_a_novel_syngeneic_model_of_spontaneous_HER2ve_breast_cancer_metastasis
[24] Yu M, Gai C, Li Z, et al. Targeted exosome-encapsulated erastin induced ferroptosis in triple negative breast cancer cells[J]. Cancer Sci, 2019, 110(10):3173-3182. http://cn.bing.com/academic/profile?id=318e5fa701cc995cd800394cce6c4a44&encoded=0&v=paper_preview&mkt=zh-cn
[25] Hasegawa M, Takahashi H, Rajabi H, et al. Functional interactions of the cystine/glutamate antiporter, CD44v and MUC1-C oncoprotein in triplenegative breast cancer cells[J]. Oncotarget, 2016, 7(11):11756-11769. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4914246/
-
期刊类型引用(1)
1. 徐丽程,田霖丽,刘鸣. 铁死亡的代谢关联机制及其在肿瘤免疫治疗中的作用研究进展. 中国肿瘤临床. 2021(01): 40-44 .  本站查看
本站查看
其他类型引用(3)



 下载:
下载:
